Chlorure de 4-toluènesulfonyle - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure de 4-toluènesulfonyle | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | chlorure de paratoluènesulfonyle chlorure de p-toluènesulfonyle chlorure de tosyle p-TsCl, TsCl | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | solide blanc | ||
| Propriétés chimiques | |||
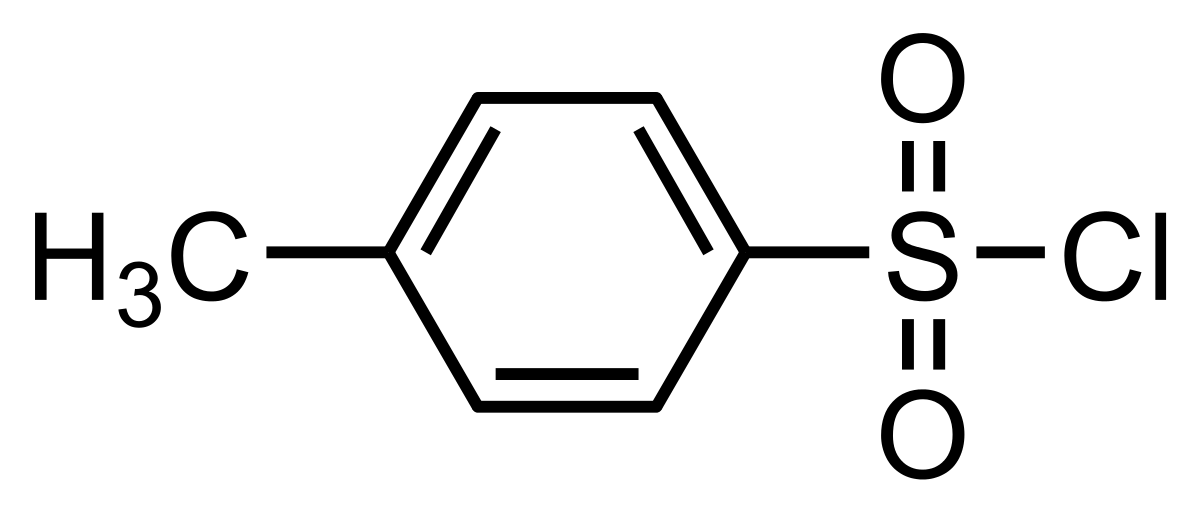
| Formule brute | C7H7ClO2S | ||
| Masse molaire | 190,647 ± 0,014 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 67 °C | ||
| T° ébullition | 135 °C à 13 mbar | ||
| T° d’auto-inflammation | 492 °C | ||
| Point d’éclair | 128 °C | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 34, | |||
| Phrases S : 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
1 3 0 | |||
| Composés apparentés | |||
| Autres composés | chlorure de benzènesulfonyle chlorure de 2-toluènesulfonyle | ||
| | |||
Le chlorure de 4-toluènesulfonyle , habituellement appelé chlorure de tosyle est un chlorure d'acide sulfonique de formule semi-développée CH3C6H4SO2Cl. Ce solide blanc (incolore) malodorant est un réactif très largement utilisé en synthèse organique. Abrégé par TsCl, c'est le dérivé du toluène portant le groupe fonctionnel chlorure de sulfonyle (-SO2Cl).
Utilisation
Caractéristiquement, TsCl convertit facilement et quantitativement les alcools (ROH) en leur ester toluènesulfonate (tosylate):
- CH3C6H4SO2Cl + ROH → CH3C6H4SO2OR + HCl
Le groupe tosylate est un excellent groupe partant contrairement au groupe hydroxyle et peut être substitué par de multiples autres groupes même peu nucléophiles.
Il peut aussi être coupé par traitement avec de l'hydrure de lithium aluminium (LiAlH4) :
- CH3C6H4SO2OR + 1/4 LiAlH4 → 1/4 LiAl(O3SC6H4CH3)4 + RH
Ainsi, il permet la suppression d'un groupe hydroxyle.
Similairement, le chlorure de tosyle est utilisé pour préparer les sulfonamides à partir d'amines:
- CH3C6H4SO2Cl + R2NH → CH3C6H4SO2NR2 + HCl
Le sulfoamide résultant n'est pas basique et même, quand il dérive d'amine primaire, il est acide.
La préparation des tosylates et des amides est conduite en présence d'une base qui absorbe le chlorure d'hydrogène (HCl). La sélection de la base est souvent cruciale pour l'efficacité de la tosylation. Typiquement, les bases utilisées sont la pyridine et la triéthylamine, d'autres bases moins courantes sont aussi employées. Par exemple, une quantité catalytique de chlorure de triméthylammonium en présence de triéthylamine a été reportée apparemment plus efficace grâce à la triméthylamine.
Production et synthèse
Le chlorure de tosyle est largement disponible et peu cher pour les usages en laboratoires. C'est un sous-produit de la production de chlorure d'orthotoluènesulfonyle via la chlorosulfonation du toluène:
- CH3C6H5 + SO2Cl2 → CH3C6H4SO2Cl + HCl



















































