Triéthylamine - Définition
La liste des auteurs de cet article est disponible ici.
| Triéthylamine | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| FEMA | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
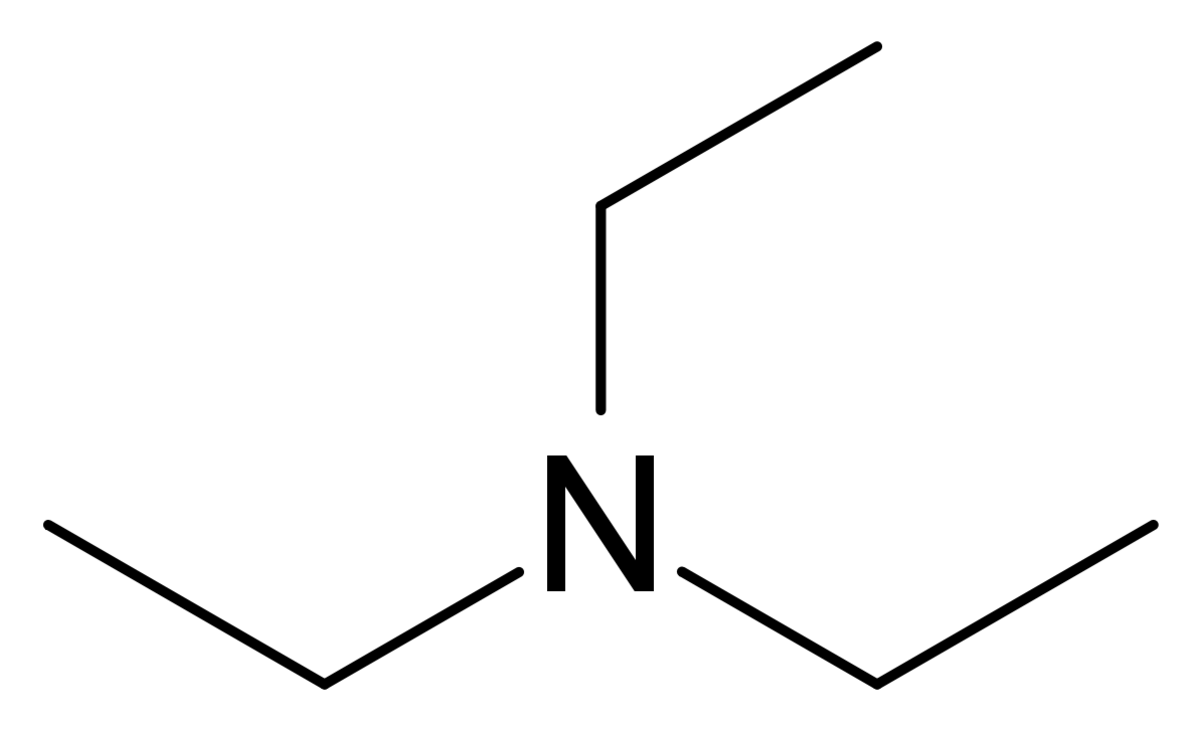
| Formule brute | C6H15N | ||
| Masse molaire | 101,19 ± 0,0061 g·mol-1 | ||
| Moment dipolaire | 0,66 ± 0,05 D | ||
| Diamètre moléculaire | 0,608 nm | ||
| Propriétés physiques | |||
| T° fusion | -115 °C | ||
| T° ébullition | 89 °C | ||
| Solubilité | dans l'eau à 20 °C : 170 g·l-1 | ||
| Masse volumique | 0,7495 g·cm-3 (0°C) | ||
| T° d’auto-inflammation | 230 °C | ||
| Point d’éclair | -17 °C (coupelle fermée) | ||
| Limites d’explosivité dans l’air | 1,2–8 %vol | ||
| Pression de vapeur saturante | à 20 °C : 7,2 kPa | ||
| Point critique | 30,3 bar, 261,85 °C | ||
| Thermochimie | |||
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 11, 20/21/22, 35, | |||
| Phrases S : (1/2), 3, 16, 26, 29, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
3 3 0 | |||
| | |||


Danger | |||
| Écotoxicologie | |||
| LogP | 1,45 | ||
| Seuil de l’odorat | bas : 0,1 ppm haut : 0,65 ppm | ||
| | |||
La triéthylamine ou N,N-diéthyléthanamine est un composé chimique de formule brute N(CH2CH3)3, couramment noté Et3N. On le rencontre fréquemment en synthèse organique] et ce parce qu'il constitue l'amine tertiaire symétrique la plus simple liquide à température ambiante. Elle présente une forte odeur de poisson proche de celle de l'ammoniac. La diisopropyléthylamine est plus largement utilisée en remplacement de Et3N. Elle est communément employée en synthèse organique comme une base, par exemple dans la préparation des esters et amides à partir des chlorures d'acide.
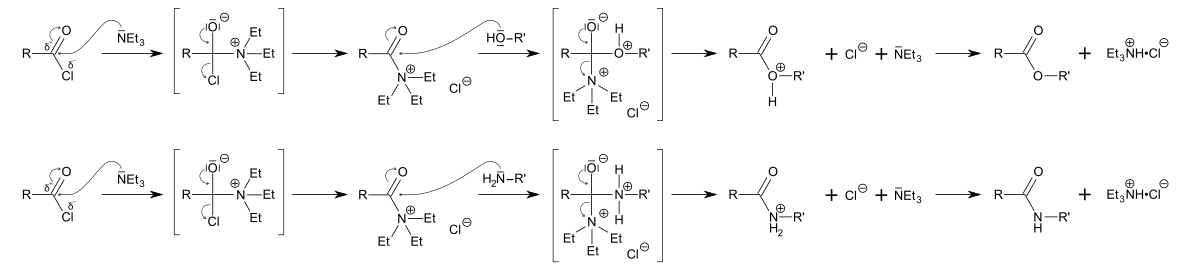
Ces réactions conduisent à la formation d'acide chlorhydrique qui, se combinant à la triéthylamine, forme un sel, le chlorhydrate de triéthylammonium. Cette réaction élimine l'acide chlorhydrique du mélange, ce qui est nécessaire pour obtenir une réaction quantitative, c'est-à-dire avec un rendement de 100%.
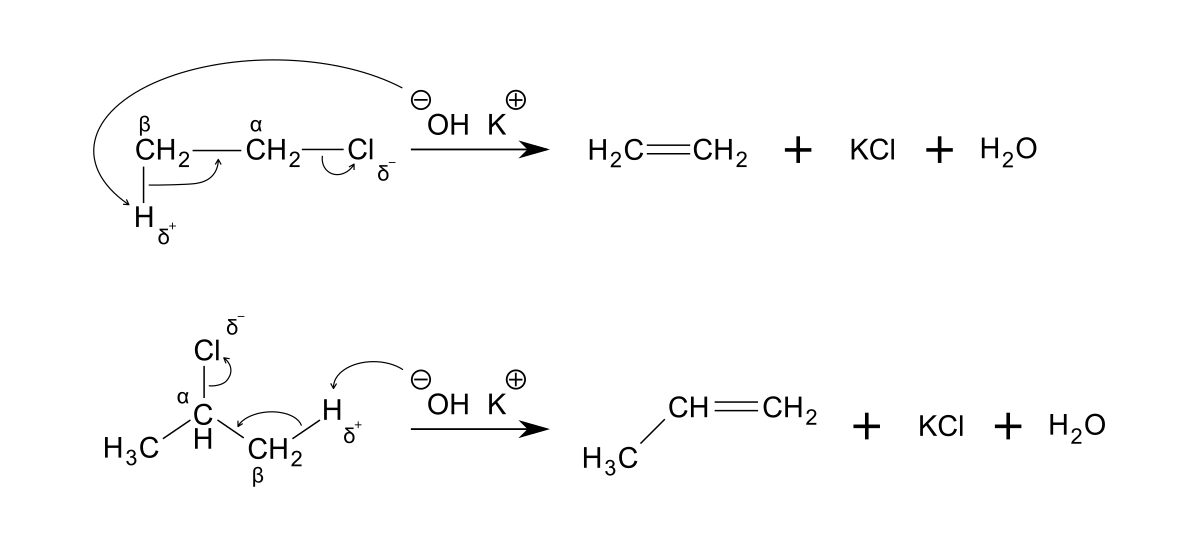
Comme les autres amines tertiaires, Et3N catalyse la formation des mousses polyuréthanes et des résines époxy. Elle est aussi très utile dans les réactions de ß-élimination :
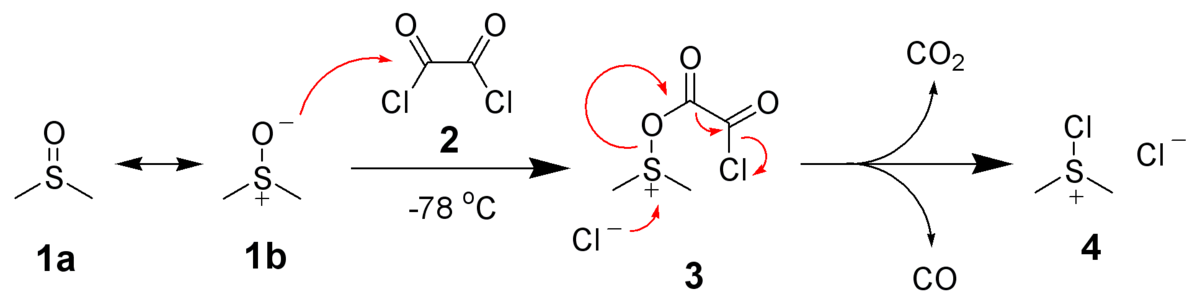
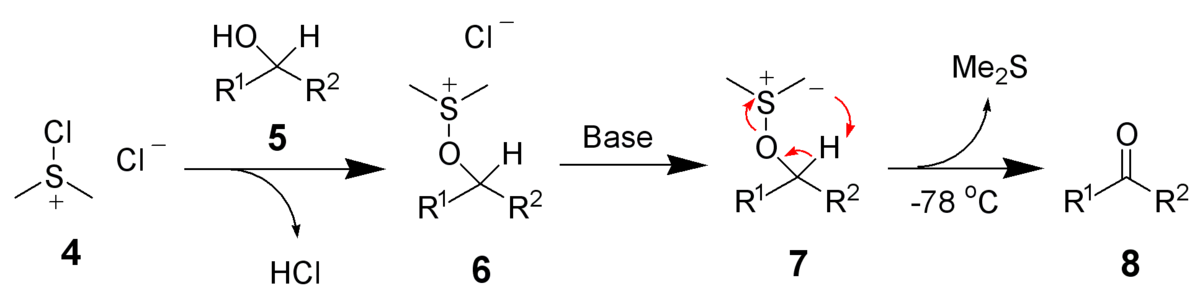
Elle est également utilisée dans les oxydations de Swern :
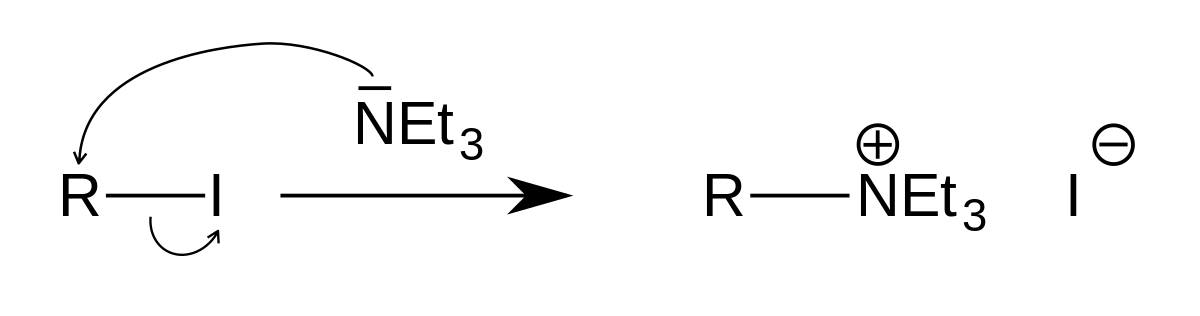
La triéthylamine s'alkyle facilement pour donner l'ammonium quaternaire correspondant :