Daxx - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
Daxx, Death domain-associated protein 6, est une protéine identifiée pour la première fois en 1997 par Yang et al. du département de biologie de l’Institut de Technologie du Massachusetts aux États-Unis dans la revue Science. Ils ont remarqué que Daxx interagissait avec Fas et son death domain. Dans cette recherche, le gène a été cloné à partir de la souris. Aujourd’hui, on sait qu'il s’agit d’une protéine présente chez plusieurs mammifères dont l'humain.
Description
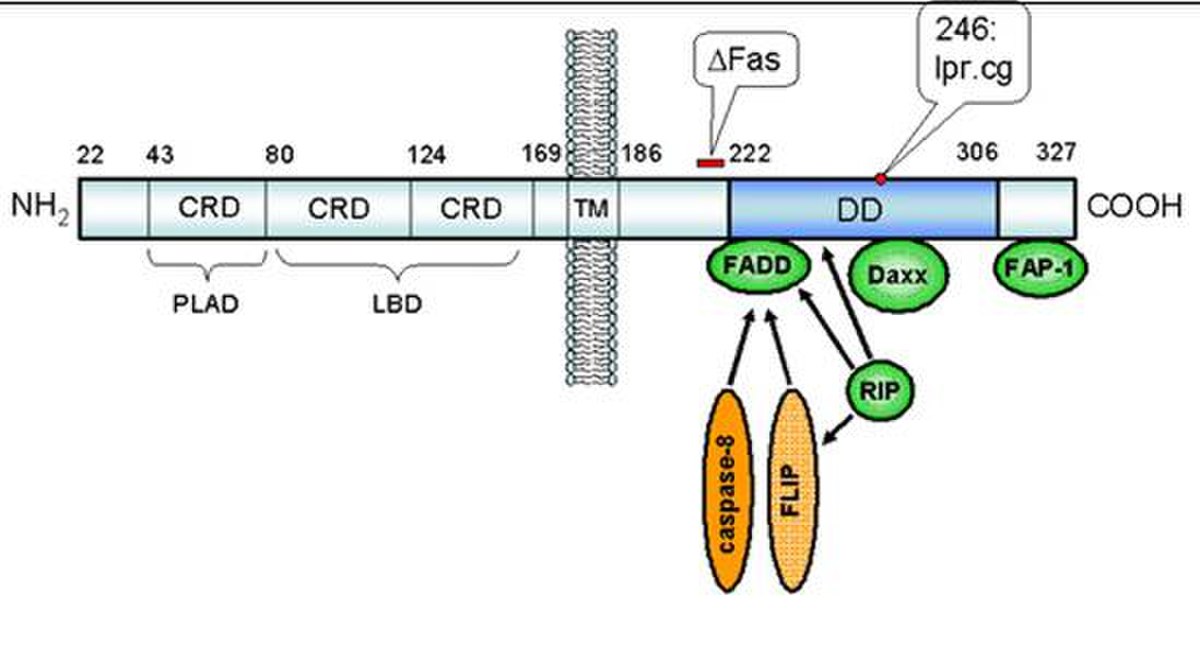
- La protéine Daxx (ou BING 2) est une molécule contenant 740 acides aminés. Elle contient une séquence de localisation nucléaire (NSL). Sa synthèse se fait dans le cytoplasme, mais elle est rapidement relocalisée au noyau par le transport nucléaire. La concentration de Daxx dans le noyau est plus importante que celle dans le cytoplasme. Elle est localisée au niveau de la matrice nucléaire avec les corps nucléaires PML (promyelocytic leukemia). L'exportine est l'une des protéines qui l'aide à quitter le noyau lors de certains signaux (stress oxydatif).
- Sa structure riche en acide glutamique lui confère une propriété acide avec un pI de 4,9. Le gène de Daxx contient 8 exons dont le premier est non-codant. L’hybridation par fluorescence in situ et l’utilisation de cellules hybrides somatiques ont permis d’identifier le gène Daxx humain sur le chromosome 6 à la région p21.3. Il s’agit d’une région contenant les gènes du CMH et des gènes impliqués dans les maladies auto-immunes. Deux sites majeurs (Lys 630 et 631) de phosphorylation interviennent dans le phénomène de la sumoylation.
Pathologies associées
- Il a été reconnu dans une étude publiée par J. Biol. Chem en 2007 que le peptidyl-prolyl isomerase Pin 1 est surexprimé dans les gliomes malins humains (tumeurs au niveau du système nerveux). À concentration normale, Pin 1 amène la survie cellulaire en protégeant la cellule contre la réponse apoptotique médiée par Daxx. Une surexpression de Pin 1 inhibe l’action cellulaire de Daxx au niveau de l’apoptose. Il phosphoryle une région de Daxx et amène sa dégradation rapide via la voie d’ubiquitine-protéasome.
- Selon une recherche publiée sur Pubmed central en 2007, Daxx pourrait être une nouvelle stratégie thérapeutique et traiter certains cancers liés à une mutation de FADD. Un infection par le virus rM51R-M induirait une réponse apoptotique plus importante par la voie de Daxx. Les données ont démontré que malgré l'absence de FADD, les cellules réussissaient à provoquer leur propre mort cellulaire. Ce virus pourrait être un atout dans un traitement combinant plusieurs techniques dont les médicaments chémothérapeutiques. La théorie selon laquelle la voie de Daxx ne peut s'activer en absence de FADD peut être remise en question.
- Une protéine a été reconnue protectrice contre l’apoptose induite par Daxx et ASK1. Il s’agit de la DJ1 qui permet la séquestration de Daxx dans le noyau et empêche son action dans le cytoplasme avec ASK1. Lors d'une mutation rencontrée dans la maladie de Parkinson, DJ1 n'est plus en mesure d'interagir avec Daxx ou de protéger la cellule du complexe Daxx-ASK1. Cela favorise l'apopotose des neurones dopaminergiques.
Fonctions principales
Apoptose
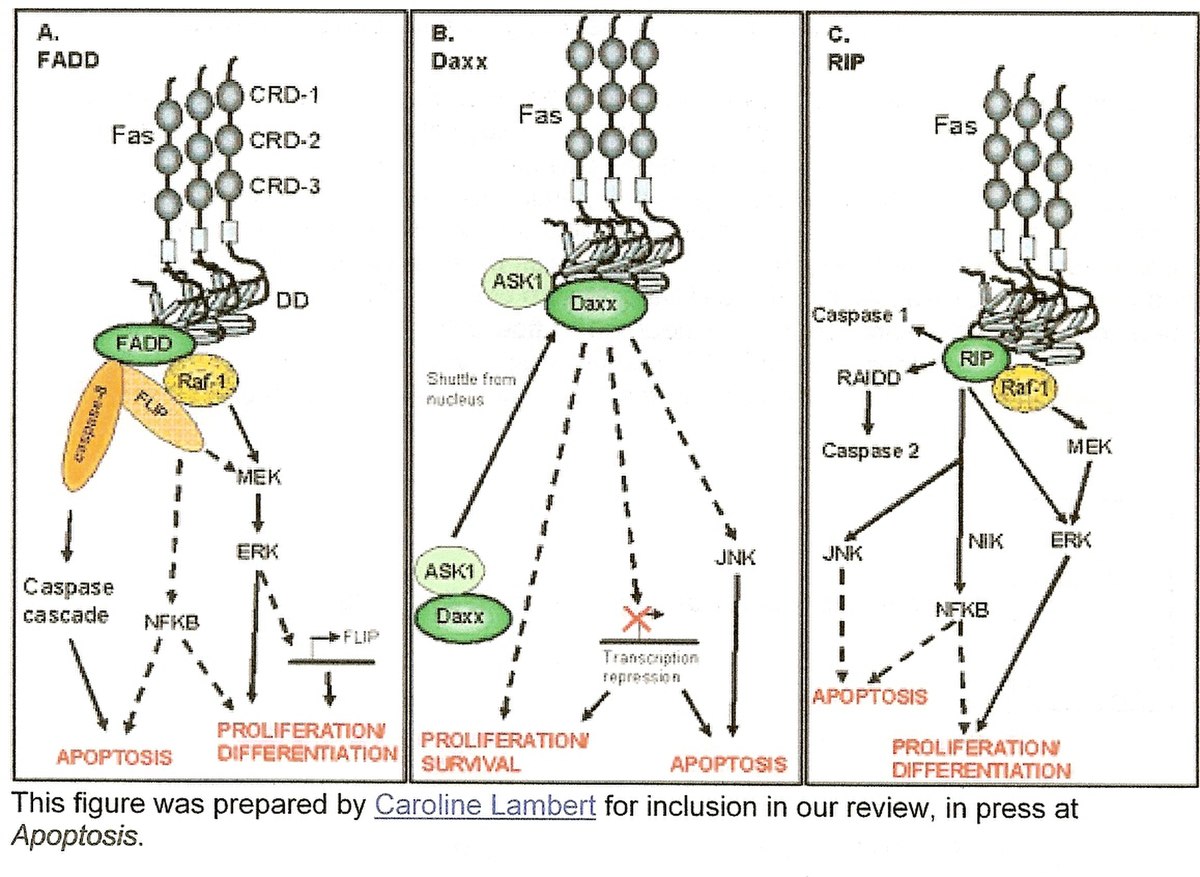
- La première fonction découverte pour la protéine Daxx est d'induire la voie d’apoptose par la protéine Fas au niveau du cytoplasme. Il a été démontré que sa surexpression potentialise l'apoptose induite par Fas et active la JNK (c-Jun-N-terminale kinase). Daxx est qualifiée de protéine pro-apoptotique et est située en aval de Fas. C’est sa région C-terminal qui interagit avec le death domain de Fas (DD). Par ailleurs, elle ne se fixe pas sur la même région que FADD. Daxx active une voie différente de celle de FADD, mais les deux agissent de concert.
- La voie de FADD implique un processus plus rapide et dépendant des caspases. La voie de Daxx, elle, active une voie plus lente qui n'intervient pas directement sur les caspases. En absence de FADD dans les lignées cellulaires, Daxx ne peut compenser ce manque. Il a été établi que Daxx interagit directement avec la protéine ASK1 (apoptosis signal-regulating kinase-1) avant d'activer la protéine JNK.
- La protéine nucléaire Hsp27, sous sa forme phosphorylée dimérique, prévient la formation du complexe Daxx-ASK1 dans le cytoplasme. En son absence, Fas ne peut pas activer la voie de Daxx. Hsp27 se fixe à Daxx, ce qui empêche celle-ci de quitter le noyau pour le cytoplasme.
- Daxx et ASK1 interviennent au niveau de JNK (c-Jun N-Terminal kinase). Cette dernière participe également à la régulation de la prolifération cellulaire. Son activation amène l’inhibition de la protéine Bcl-2 qui est un inhibiteur de l’apoptose. Bcl-2 bloque en particulier l’activité de la protéine Bax. Cette levée d’inhibition permet la formation de pores dans les mitochondries et favorise la sortie du cytochrome c. Le cytochrome c est une molécule très toxique pour la cellule. Lorsqu'il se lie à la protéine Apaf, il y a protéolyse de la caspase initiatrice 8. La voie des caspases est enclenchée et mène à la fragmentation de l’ADN, puis ultimement, à la mort cellulaire par apoptose. L’activation de la JNK n’est pas une étape essentielle dans l’induction de la mort cellulaire programmée par Fas.[1] Son inhibition a peu d'effet sur l'apoptose (voie de FADD présente).
Régulation de la transcription
- Par la présence d'une séquence de localisation nucléaire (NSL), Daxx interagit dans le noyau. Une surexpression de la protéine MSP58 y cause sa séquestration. Cette conséquence amène l'augmentation de la répression de la transcription de gènes.
- La protéine Daxx, en association avec la protéine DMAP1, permet la répression de l'expression du récepteur glucocorticoïde dans le noyau. Sa liaison avec des facteurs de transcription font d'elle un corépresseur de transcription. Elle inhibe l'expression de certains gènes. C'est le cas entre autres de Pax3, ETS1, E2F1 et p53. Daxx régulerait aussi la transcription de gènes impliqués dans la cascade d'activation des caspases.
Autres fonctions
- Il est reconnu que Daxx peut se lier à l'ASV intégrase, protéine présente chez l'ASV (avian sarcoma virus). Cette association supprime la réplication virale. Elle agit de façon similaire avec la protéine virale pp71. Daxx joue donc un rôle dans la défense cellulaire contre les infections virales. Elle maintiendrait la stabilité du génome contre une intégration extrinsèque dans l’ADN cellulaire.
- Il a été admis que Daxx interagit avec certaines protéines dont l'histone déacytylase II et la chromatin-associated protein DEK. Elle participerait à la structure de la chromatine et expliquerait en partie son habileté à réprimer la transcription.