Difluor - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
| Difluor | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Apparence | gaz comprime, jaune, d'odeur acre. | ||
| Propriétés chimiques | |||
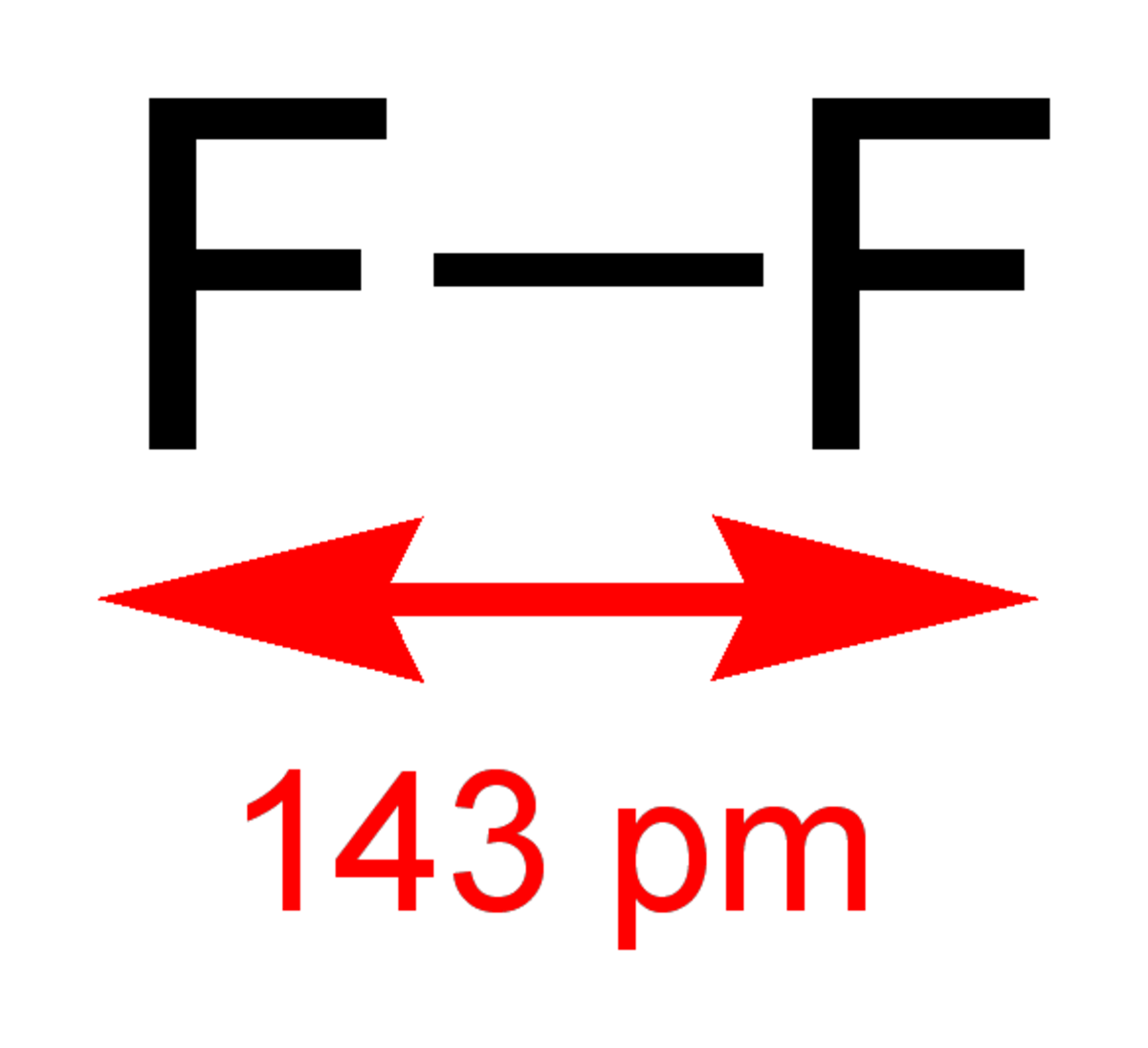
| Formule brute | F2 | ||
| Masse molaire | 37,9968064 ± 1,0E-6 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -219 °C | ||
| T° ébullition | -188 °C | ||
| Solubilité | dans l'eau : réaction | ||
| Masse volumique | liq à -188,13 °C : 1.5127 | ||
| Pression de vapeur saturante | |||
| Point critique | 52,2 bar, -128,85 °C | ||
| Thermochimie | |||
| ΔH° | 6,62 kJ·mol-1 (1 atm, -188,12 °C) | ||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 15,697 ± 0,003 eV (gaz) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 7, 26, 35, | |||
| Phrases S : (1/2), 9, 26, 36/37/39, 45, | |||
| | |||
|
0 4 4 | |||
| | |||




| |||
| | |||




Danger | |||
| Inhalation | irritation, spasmes bronchiaux, œdème pulmonaire | ||
| Peau | brûlures | ||
| Yeux | irritation, brûlures | ||
| Ingestion | taches dentaires, ostéosclérose | ||
| Écotoxicologie | |||
| CL | rats 185 ppm (volume), souris 150 ppm, cochons d'Inde 170 ppm | ||
| Seuil de l’odorat | bas : 0,09 ppm haut : 0,19 ppm | ||
| | |||
Le difluor (F2) est une molécule formée de deux atomes de fluor.
Le difluor est un gaz jaune pâle, d'odeur irritante, difficile à liquéfier. Le difluor est l'un des corps les plus réactifs de toute la chimie ; il réagit pratiquement avec toutes les substances sauf trois gaz rares (l'hélium, le néon et l'argon), quelques polymères organiques fluorés et certains alliages spéciaux.
Ce gaz fut découvert en 1771 par le chimiste suédois Carl Wilhelm Scheele et fut isolé en 1886 par le chimiste français Henri Moissan.




















































