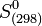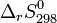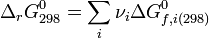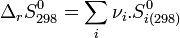Enthalpie standard de formation - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Remarques
- De la même manière et pour les mêmes raisons, il a été défini une enthalpie libre standard de formation à T :
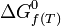
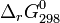
- Ce qui permet d'avoir accès à la constante d'équilibre,
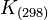
- En revanche l'entropie d'un corps pur peut être calculée de façon absolue (voir Calculs de l'entropie d'un corps pur), donc il n'est pas nécessaire de définir une entropie standard de formation. Les entropies molaires standards à 298 K :