Exergie - Définition
La liste des auteurs de cet article est disponible ici.
Définitions dans des cas particuliers
Pour un système de composition chimique donnée, à pression et entropie données, on peut utiliser l'enthalpie H pour exprimer l'exergie :
-
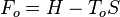
Pour un système de composition chimique donnée, à température et volume donnés, on peut utiliser l'Énergie libre F:
-
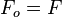
-
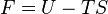
Pour un système de composition chimique donnée, à température et pression données, on peut utiliser l'Enthalpie libre G:
-
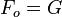
-
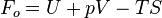
Exergie monobare
Tout se généralise dans le cas d'un pressostat de pression P°, lors d'une transformation monotherme. Ce qui interviendra est G°(T,P) = U + P°V - T°S, et tous les raisonnements tiennent à condition de parler du travail W* , autre que celui des forces de pression (égal à -P°Δ V).
Notion de potentiel F°
Bien sûr, si W=0 , le système ne peut évoluer que vers l'état où F° sera minimal ; et il y restera. Oh ! mais voilà qui exige rééducation de l'intuition mécanique usuelle : ce n'est pas l'état d'énergie U minimale qui est l'équilibre.
Ce n'est pas non plus S maximal, car le système peut rétrocéder de l'énergie au thermostat.
En définitive, ni l'un ni l'autre, mais minimum conjoint de U-T°S= F°(T,V).
À volume constant, cela donne
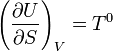
Donc, à l'équilibre monotherme isochore, F°(T, V) = F(T°,V) ; cela justifie qu'en chimie, on utilise pratiquement toujours l'énergie libre F et non pas l'exergie F°.
Stabilité de l'équilibre
La considération de la différence seconde qui doit être positive donne des inégalités intéressantes, dites inégalités de Le Châtelier (ou inégalités de Le Châtelier-Braun).

















































