Exergie - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En thermodynamique, l'exergie est une grandeur permettant de calculer le travail maximal que peut fournir un système à l'extérieur lorsqu'il se met à l'équilibre thermodynamique avec son environnement. Le travail maximum récupérable est égal à l'opposé de la variation d'exergie au cours de la transformation.
Si l'énergie ne peut que se transformer sans jamais se détruire (voir Premier principe de la thermodynamique), l'exergie ne peut en revanche que diminuer dans les transformations réelles. L'exergie détruite au cours d'une réaction est appelé anergie. Ce phénomène est lié à l'entropie du système et de son environnement, qui ne peut qu'augmenter au cours d'une transformation réelle, non réversible. (voir Deuxième principe de la thermodynamique)
Définition générale
Par définition l'exergie d'un système est égale à zéro lorsqu'il est à l'équilibre thermodynamique avec son environnement.
Cet équilibre comprend :
- l'équilibre mécanique avec les forces extérieures, notamment celles de pression ;
- l'équilibre thermique avec la température extérieure ;
- l'équilibre chimique entre les potentiels chimiques des espèces présentes dans le système et dans l'environnement.
Ce n'est pas une fonction d'état du système car elle est définie par :
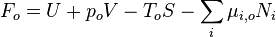
Elle est donc la combinaison de deux fonctions d'état (dépendant du système) : l'énergie interne U et l'entropie S, un paramètre extensif du système : le volume V, et deux paramètres intensifs liés à l'environnement : la température environnante To, et la pression environnante po.
Elle est formée de paramètres relatifs au système :
- U, l'énergie interne, en joules ;
- S, l'entropie, en joules par kelvin ;
- V, le volume, en mètres-cubes ;
- Ni, la composition chimique du système, en moles.
Et de paramètres relatifs à l'environnement :
- To, la température environnante, en kelvin ;
- po, la pression environnante, en pascal ;
- μi,o, les potentiels chimiques des composants, en joules par mole.
Elle est notée Fo pour signifier qu'elle dépend à la fois du système et de son environnement. Le choix de la lettre F est à cause de sa similitude avec l'Énergie libre.
Cette fonction a été très étudiée après Duhem (1861-1916) par Gouy (1854-1926), mais le terme « exergie » n'a été introduit qu'en 1956 par Zoran Rant. Un peu tombée en désuétude, malgré son utilisation par Einstein, elle revient par le biais ingénieur des réflexions sur le gaspillage lors des années 70, à la suite du choc pétrolier.
Considérations de coûts énergétique
L'analyse d'un système par l'exergie permet mesurer le degré d'irréversibilité d'une transformation dans un environnement de température T°. Cette fonction est aussi appelée « énergie disponible » ou « disponibilité énergétique » (en anglais : availability), car on démontre que sa chute entre un état A et un état B est le travail maximal récupérable :
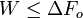
Comme cela est peu intuitif, il est utile de détailler les 4 cas possibles :
- si l'on chute énergétiquement d'un état A désordonné vers un état B ordonné, il faut payer le prix de l'information gagnée (-T°Δ S), on ne pourra récupérer que moins que - Δ U , et plus précisément -Δ U + (+T°Δ S,négatif hélas!) ;
- si au contraire A est ordonné et B désordonné , ce serait du gaspillage que de récolter seulement - Δ U .Il faut récolter plus :- Δ U + (T°Δ S, boni positif à ne pas manquer) ;
- si l'on monte énergétiquement d'un état A désordonné vers un état ordonné, il va falloir payer le prix fort : non seulement W > ΔU > 0, mais plus encore, W > ΔU + le prix de l'information à payer -T° ΔS, positif ;
- par contre, si l'on monte énergétiquement d'un état ordonné vers un état désordonné, on aura à payer moins que Δ U >0 d'une quantité -T°Δ S, négative.
Il se pourrait même que l'on récupère du travail dans l'opération, si B est très désordonné : voilà qui n'était pas , a priori, intuitif : certaines piles au mercure et calomel réalisent cet apparent prodige.
Dès que l'on a pris conscience que récupérer de l'information chaude coûte cher, tout devient assez raisonnable : prendre l'exemple de la boîte de Maxwell ; on conçoit bien que séparer les billes blanches et noires dans chaque compartiment est d'autant plus difficile que les bords de la boîte sont vibrants à une haute température T°. C'est même très exactement ce prix que l'on doit payer pour séparer de l'hexafluorure d'uranium 235 de son isotope 238 : faire fonctionner « un démon de Maxwell » coûte d'autant plus que les particules vont vite.

















































