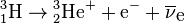Tritium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Tritium (Hydrogène 3) | |
|---|---|
| Général | |
| Nom, Symbole | tritium, triton, 3H |
| Neutrons | 2 |
| Protons | 1 |
| Données Physiques | |
| Présence naturelle | trace |
| Demi-vie | 12,32 ans ± 0,02 ans |
| Produit de désintégration | hélium 3 |
| Masse atomique | 3,016049200 uma u |
| Spin | 1/2+ |
| Excès d'énergie | 14 949,794 ± 0,001 keV |
| Énergie de liaison | 8 481,821 ± 0,004 keV |
| Désintégration | Énergie (MeV) |
| Désintégration bêta | 0,018590 |
Le tritium (T ou 3H) est - comme le deutérium - l'un des isotopes de l'hydrogène. Il possède 1 proton et 2 neutrons. Il a été mis en évidence en 1934, par Ernest Rutherford, dans la réaction nucléaire D+D->T+p.
A la différence du deutérium, cet élément est radioactif. Il émet un rayonnement bêta (β-) (de faible énergie) en se transformant en hélium 3 (3He).
Sa période ou demi-vie est de 12,32 ans.
Son activité spécifique (ou activité massique) est de 3,59×1014 Bq/g (soit 1 g = 359 TBq).
Propriétés

Propriétés physiques
Le tritium a une masse atomique de 3,0160492. Il est gazeux (HT ou T) dans les conditions normales de température et de pression
La légère différence massique d'une même molécule selon qu'elle contienne des atomes d'hydrogène ou de tritium explique des différences de comportements, en particulier concernant l'eau tritiée lors des processus naturels de changement de phase (évaporation, condensation, cristallisation..) source d'un faible enrichissement en tritium de la phase condensée par rapport à l’hydrogène (plus léger).
Comme l'hydrogène, le tritium gazeux est difficile à stocker à température ambiante.
Propriétés chimiques
En s'oxydant en présence d'oxygène, même en milieu sec il produit de l'eau tritiée (HTO ou TO), s'il y a une source de chaleur ou une étincelle. (Oxydation, tout comme l'isotope léger H) ; environ 1 % du tritium est converti en 1 heure, et d'autant plus vite que le milieu sera humide.[réf. souhaitée]
Radioactivité
La demi-vie du tritium est de 12,32 ans.
Il se transforme en hélium 3 par la réaction :
La réaction dégage une énergie maximale (Emax) de 18,6 keV et moyenne (Emoy) de 5,7 keV ; l'électron emportant en moyenne une énergie cinétique de 5,7 keV, le reste étant emporté par un antineutrino électronique (pratiquement indétectable). Son énergie particulièrement faible le rend difficile à détecter autrement que par scintigraphie.
La radioactivité β de faible énergie fait que les électrons émis sont rapidement arrêtés dans l'eau et dans les tissus biologiques, après avoir parcouru seulement 6 μm tout au plus (et en moyenne environ 0,56 μm). Un rayonnement externe est donc rapidement arrêté par la simple surface « morte » de la peau humaine. Cependant, contrairement à leur rayonnement, la plupart des molécules tritiées (HTO ou OBT) sont facilement absorbées à travers la peau, des membranes ou tissus biologiques de tous les êtres vivants.
Sa radioactivité ne le rend donc dangereux que s'il est inhalé ou ingéré et a priori uniquement dans les cellules vivantes qu'il aura pénétré.