Oxalate de calcium - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Oxalate de calcium | |||
|---|---|---|---|
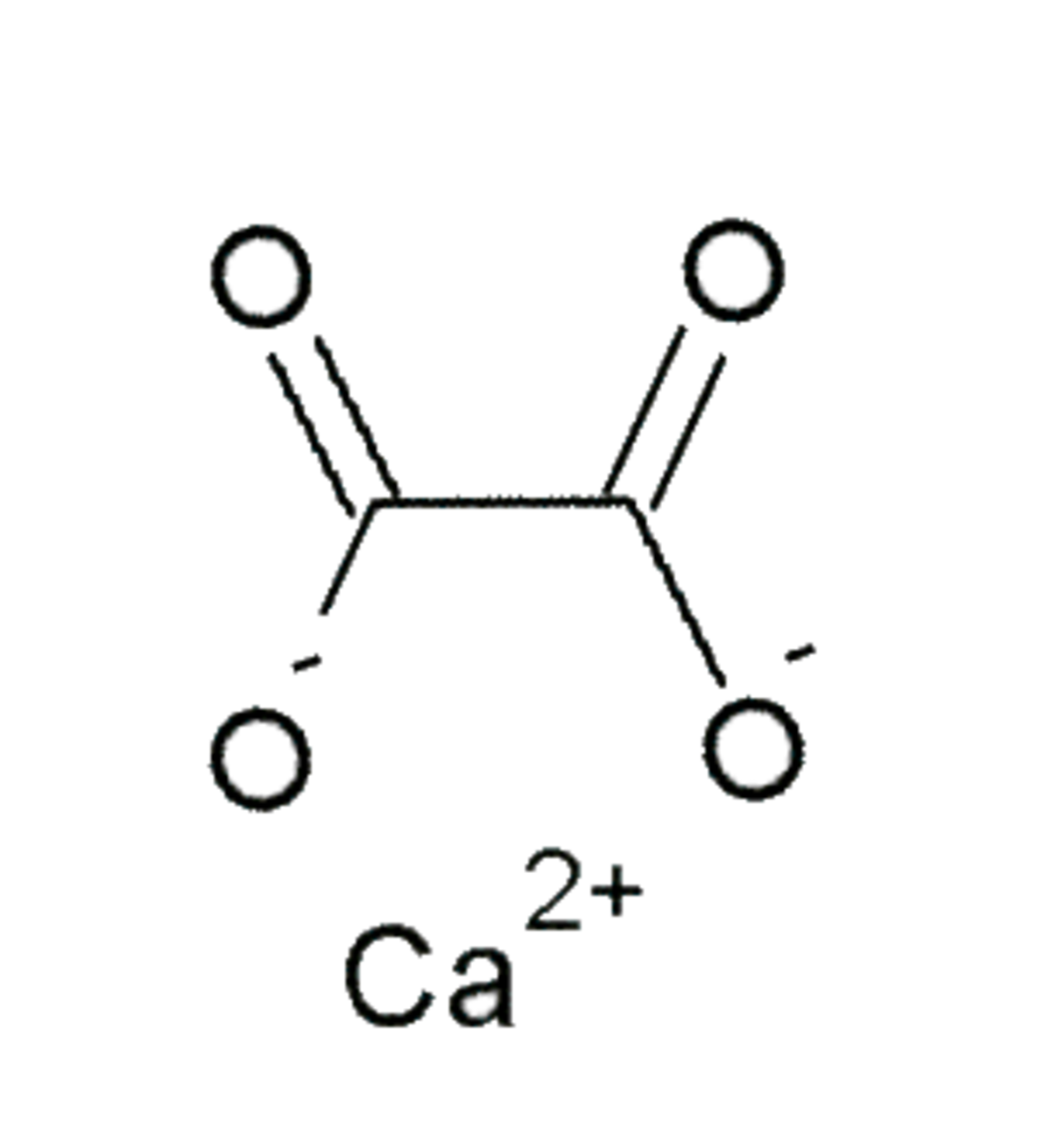
| |||
| Général | |||
| No CAS | (anhydre) (monohydrate) | ||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule brute | CaC2O4 | ||
| Masse molaire | 128,097 ± 0,007 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 200 °C (monohydrate) | ||
| Solubilité | 0,0006 g/100 g (eau, 18 °C) | ||
| Masse volumique | 2,12 g·cm-3 (monohydrate, 20 °C) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 20/21/22, 36/37/38, | |||
| Phrases S : 26, 37/39, | |||
| | |||
| |||
| | |||
|
0 3 1 | |||
| Écotoxicologie | |||
| DL | 375 mg·kg-1 (rat, oral) | ||
| | |||
L'oxalate de calcium est un cristal ionique insoluble dans l'eau, de formule Ca(COO)2 ou CaC2O4, composé d'un ion calcium Ca2+ et d'un ion oxalate -OOC-COO-, dérivé de l'acide oxalique.
70 à 80 % du contenu de la plupart des calculs rénaux sont composés d'oxalate de calcium dihydraté (calculs plutôt jaunes avec de petites aspérités) ou monohydraté (calculs plutôt noirs).
Sources, présence
On le rencontre
dans les minéraux :
-
- whewellite (monohydrate)
- weddellite (dihydrate)
- caoxite (trihydrate)
et chez certaines plantes riches en acide oxalique où il peut prendre la forme de fins spicules ou raphides, ce qui occasionne de sévères irritations des muqueuses aux herbivores qui tenteraient d’en manger
-
- bulbes de la famille des liliacées (occasionnant des dermatites à ceux qui manipulent ces bulbes en grande quantité)
- aracées
- sève de jonquille
- Lentilles d'eau (lemna minor)
- feuilles de la rhubarbe (qui en contient à des doses toxiques)
- Jussie rampante (plante introduite en Europe, devenue invasive)
- yucca
- oseille



















































