Acide oxalique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide oxalique | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | sel d'oseille | ||
| No CAS | (anhydre) (dihydrate) | ||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | cristaux incolores inodores | ||
| Propriétés chimiques | |||
| Formule brute | C2H2O4 | ||
| Masse molaire | 90,0349 ± 0,0029 g·mol-1 126,07 g⋅mol-1 (dihydrate) | ||
| pKa | pKA1 = 1,2 (à 25 °C) pKA2 = 4,3 (à 25 °C) | ||
| Propriétés physiques | |||
| T° fusion | 189,5 °C (α) 182 °C (β) | ||
| T° ébullition | >160 °C (décomposition en acide formique, CO, CO2, H2O) | ||
| Solubilité | 220 g·l-1 (eau, 25 °C), dans l'eau : 100 g·l-1 (dihydrate) | ||
| Masse volumique | 1,9 g·cm-3 (20 °C) 1,653 g·cm-3 (dihydrate) | ||
| Point d’éclair | 166 °C | ||
| Thermochimie | |||
| ΔH0 | -829 kJ/mol | ||
| Cp | 106 J/mol·K | ||
| Cristallographie | |||
| Classe cristalline ou groupe d’espace | Pbca | ||
| Paramètres de maille | a = 6,559 Å b = 6,094 Å | ||
| Volume | 313,88 Å3 | ||
| Densité théorique | 1,905 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 21/22, | |||
| Phrases S : 2, 24/25, | |||
| | |||
| |||
| | |||
|
1 3 0 | |||
| | |||
Acide oxalique :
Acide oxalique dihydraté : 
| |||
| | |||

Attention | |||
| Inhalation | Les vapeurs peuvent être mortelles. | ||
| Peau | Peut provoquer de graves blessures. | ||
| Yeux | Très dangereux, brûlures profondes. | ||
| Ingestion | Ingestion toxique, voire mortelle | ||
| Autre | Émission de fumées toxiques en brûlant | ||
| Écotoxicologie | |||
| DL | 375 mg·kg-1 (rat, oral) 270 mg·kg-1 (souris, i.p.) | ||
| LogP | -0,7 (estimé) | ||
| | |||
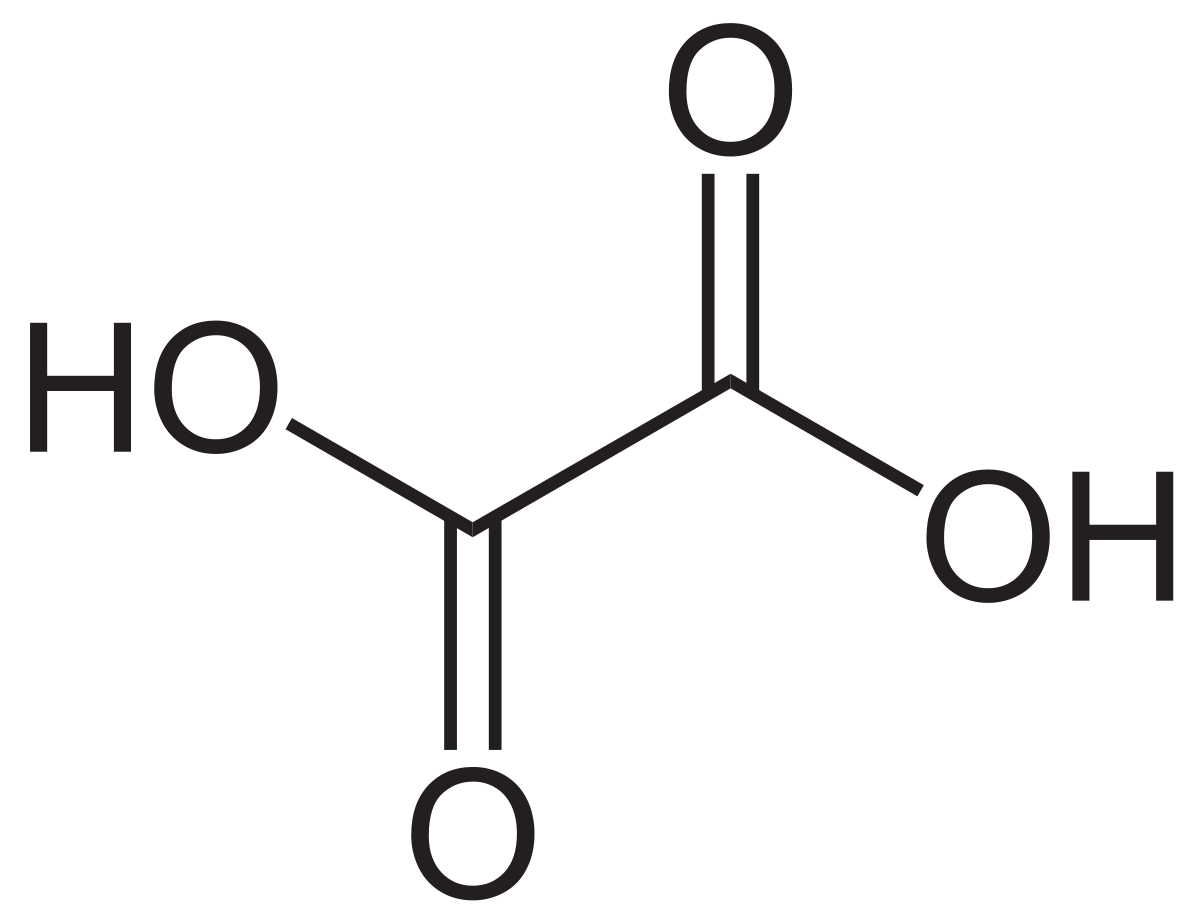
L'acide oxalique de structure HOOC-COOH, l'acide éthanedioïque d'après la nomenclature officielle est le plus simple des acides dicarboxyliques aliphatiques. Le produit commercial est un dihydrate, HOOC-COOH,2H2O
Grâce à la liaison entre les deux groupes carboxyles, il est l'un des acides organiques les plus forts (pKA1 = 1,27 et pKA2 = 4,27). Les anions de l'acide oxalique ainsi que les sels et esters sont connus sous le nom d'oxalates.
Origine et fabrication
On le trouve à l'état naturel sous forme d'oxalate de potassium ou de calcium dans les racines et rhizomes de nombreuses plantes telles que l'oseille, la rhubarbe, la betterave et les plantes de la famille des oxalis. Ce dernier terme d'origine grecque signifie oseille. Le sel d'oseille est connu et d'emploi commun comme rongeant, décolorant en teinture, détartrant et complexant éliminant les tâches de rouille, vernis et encres depuis le XVIIIe siècle.
Le composé chimique pur a été découvert en 1776 par le chimiste suédois Carl Wilhelm Scheele en procédant à l'oxydation du sucre par l'acide nitrique d'où son autre nom : l'acide de sucre. Friedrich Wöhler synthétise en 1824 ce produit naturel, et inaugure ainsi la synthèse chimique de produit naturel, détruisant la vigueur des doctrines vitalistes qui séparaient drastiquement autrefois le règne minéral du règne végétal ou animal. Les oxalates sont présents dans l'urine animale et humaine, ils forment aussi des composés minéraux dans les rognons de silex.
Fabrication industrielle
L'oxydation des glucides les plus communs, en particulier l'amidon, voire la sciure de bois, donne l'acide oxalique, qui était souvent transformé autrefois sous forme de sels de potassium, d'où le nom de sel d'oseille. Les différents procédés d'autrefois comportaient la fusion alcaline de la cellulose. On pouvait aussi obtenir l'acide oxalique avec le monoxyde de carbone et la soude à 300 °C. Un autre procédé équivalent consiste à chauffer le formiate de sodium.
De façon industrielle (Rhône-Poulenc), l'acide oxalique est obtenu par deux oxydations successives, à l'aide d'acide nitrique puis de dioxygène de l'air en présence d'un catalyseur.
Aliments à forte teneur
L'acide oxalique et les oxalates sont des substances toxiques que l'on trouve dans de nombreuses plantes. On trouve parmi les aliments ayant une forte teneur en acide oxalique le cacao, le chocolat, les noix et noisettes, les baies, la rhubarbe, les haricots, l'oseille et les épinards.
| Plante | Acide oxalique (mg/100g, masse sèche) |
|---|---|
| Épinards | 460 – 3200 |
| Rhubarbe | 500 – 2400 |
| Blette | 690 |
| Persil | 190 |
| Betterave | 340 |
| Feuilles de betterave | >12 000 |
| Cacao | 4500 |
| Thé | 3700 |
| cladodes de platyopuntia | 13 000 |
Certaines espèces de Penicillium et Aspergillus convertissent le sucre en oxalate de calcium avec un rendement de 90% dans les conditions optimales.