Pentachlorure de phosphore - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
| Pentachlorure de phosphore | |||
|---|---|---|---|
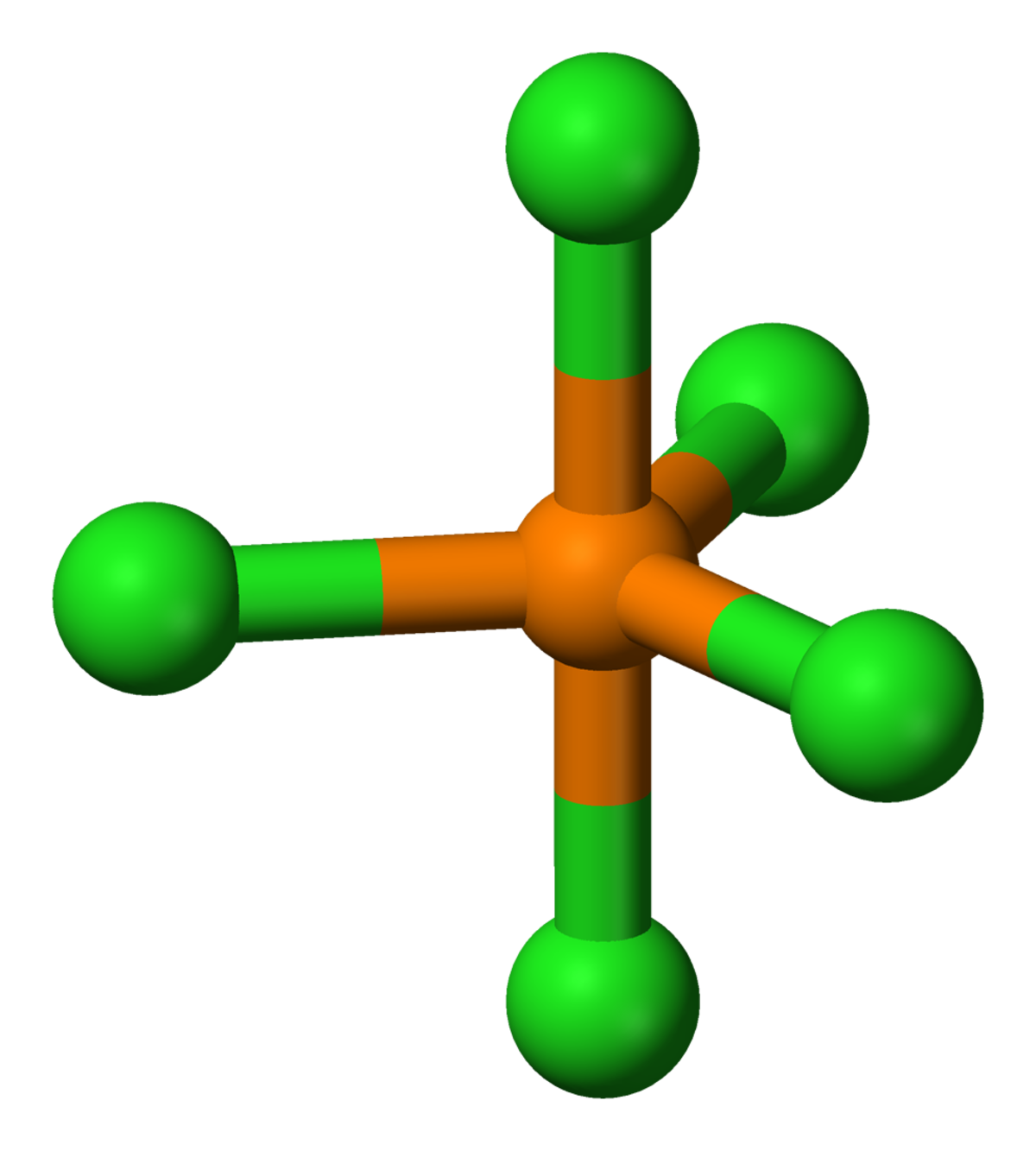
| |||
| Général | |||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | poudre cristalline jaune pâle, d'odeur âcre | ||
| Propriétés chimiques | |||
| Formule brute | PCl5 | ||
| Masse molaire | 208,239 ± 0,01 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | Point de sublimation : 100 °C décomposition à 167 °C | ||
| Solubilité | Réagit avec l'eau | ||
| Masse volumique | 1.6 | ||
| Pression de vapeur saturante | à 55,5 °C : 133 Pa | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 14, 22, 26, 34, 48/20, | |||
| Phrases S : (1/2), 7/8, 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
0 3 2 | |||
| | |||



| |||
| | |||


Danger | |||
| Inhalation | oedème pulmonaire | ||
| Peau | peut être absorbée | ||
| Écotoxicologie | |||
| DL | 660 mg·kg-1 (rats, oral) | ||
| Valeur d'exposition | 1 mg·m-3 | ||
| | |||
Au contact de l'eau, le pentachlorure de phosphore dégage du chlorure d'hydrogène et de l'acide phosphorique.
Attaque le plastique et le caoutchouc. Il peut être utiliser pour former un dérivé halogène à partir d'un alcool ou un chlorure d'acyle à partir d'un acide carboxylique.



















































