Pentoxyde de phosphore - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Pentoxyde de phosphore | |||
|---|---|---|---|
| |||
| Général | |||
| No CAS | |||
| No EINECS | |||
| Apparence | cristaux blancs, hygroscopiques ou poudre. | ||
| Propriétés chimiques | |||
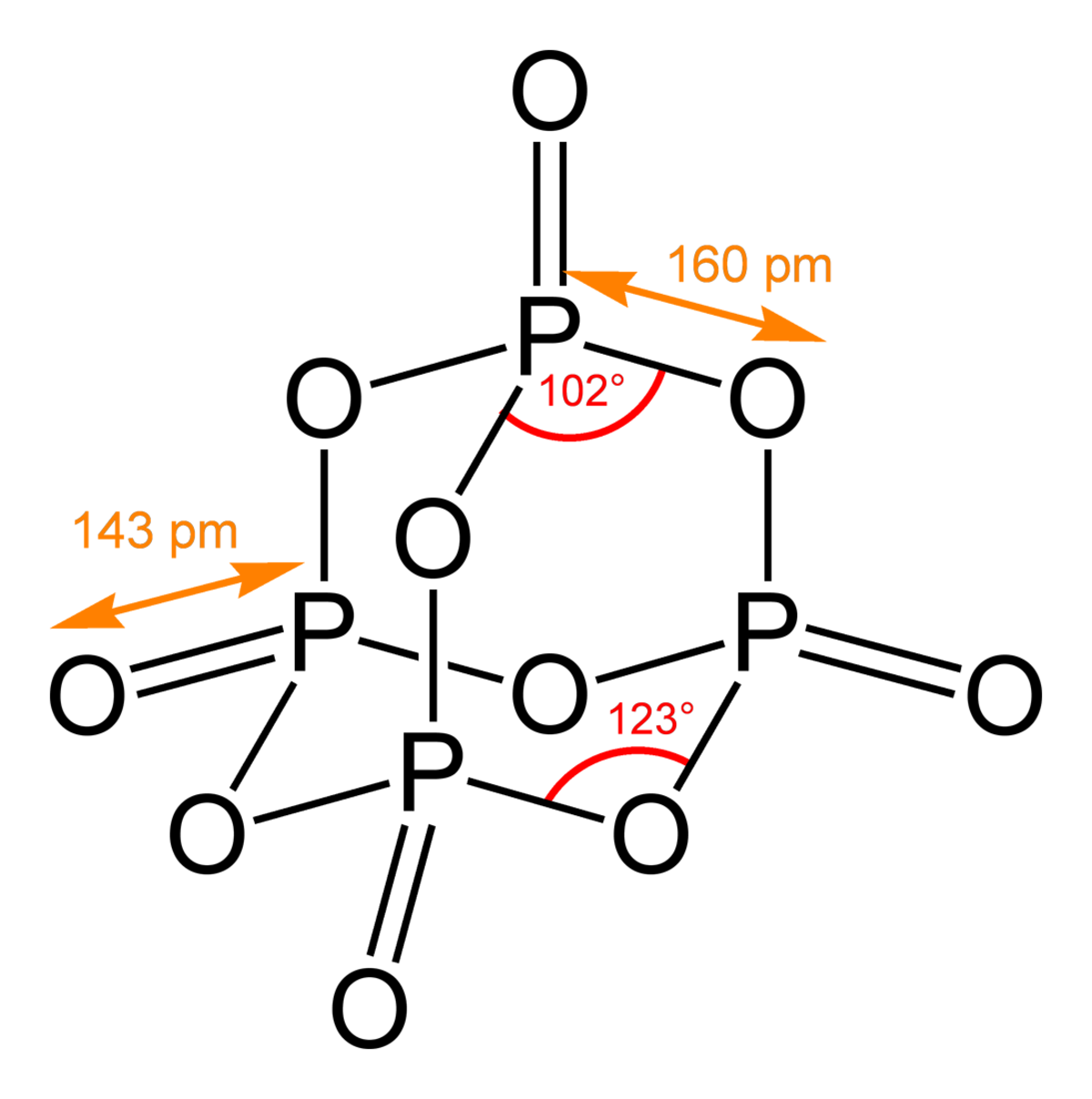
| Formule brute | P2O5 ou P4O10 | ||
| Masse molaire | 141,9445 ± 0,0015 g·mol-1 283,889 g mol-1 (P4O10) | ||
| Propriétés physiques | |||
| T° fusion | 340 °C | ||
| T° ébullition | Point de sublimation : 360 °C | ||
| Solubilité | dans l'eau : réaction | ||
| Masse volumique | 2,4 g·cm-3 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 35, | |||
| Phrases S : (1/2), 22, 26, 45, | |||
| | |||
| |||
| | |||


| |||
| | |||

Danger | |||
| | |||
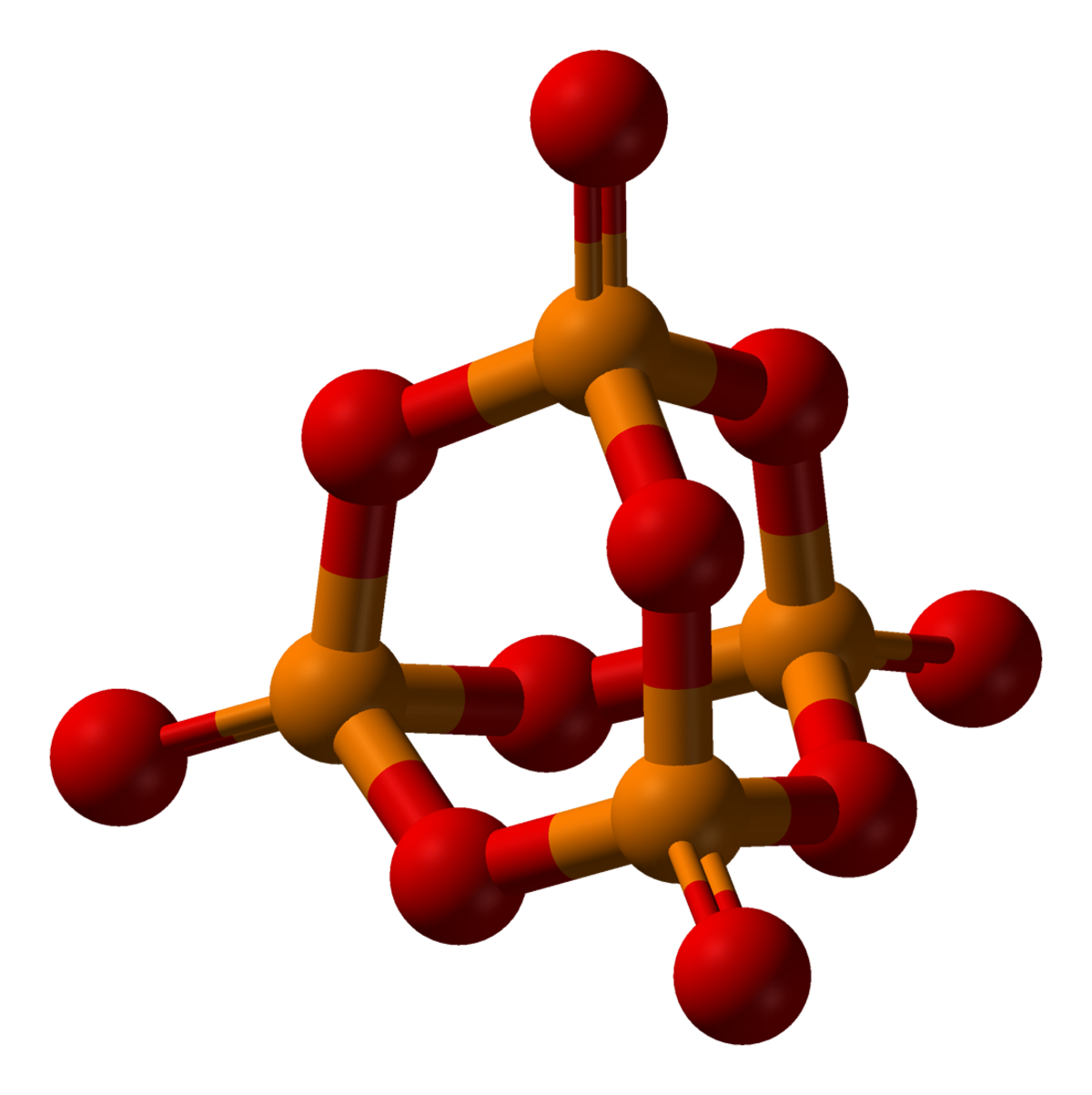
Le pentoxyde de phosphore est un composé moléculaire de formule P4O10. C'est un composé fortement hygroscopique qui se transforme en acide phosphorique en s'hydratant.
Utilisations
Le pentoxyde de phosphore est utilisé comme très puissant déshydratant, par exemple pour la synthèse d'anhydride d'acide à partir d'acides carboxyliques selon R − COOH + R' − COOH = R − CO − O − CO − R' + H2O Il ne peut cependant être utilisé que si les chaînes carbonées R sont suffisamment simples. En effet on obtient lors de cette synthèse de l'acide phosphorique comme sous-produit. Le pentaoxyde de phosphore est aussi utilisé comme desséchant dans les dessiccateurs