Polymérisation en chaîne - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Une polymérisation en chaîne est une polymérisation dans laquelle la croissance d’une chaîne polymère résulte exclusivement d’une ou plusieurs réactions entre monomère et site réactif de la chaîne polymère, avec régénération du ou des sites réactifs à la fin de chaque étape de croissance. Une polymérisation en chaîne comporte des réactions d’amorçage et de propagation et peut également inclure des réactions de terminaison et de transfert de chaîne.
Pour qu'une polymérisation en chaîne se développe, il faut la création de centres actifs qui ne préexistent pas dans le monomère. Ces centres actifs (équivalents des intermédiaires réactionnels en cinétique chimique) peuvent être des carboradicaux, carbocations, carbanions... Ce sont eux qui permettent la croissance de la chaîne.
À la différence de la polymérisation par étape, on obtient des polymères de degré moyen beaucoup plus élevé (n de 103 à 106) en des temps beaucoup plus courts (t de 1 s à 1 min). Un centre actif additionne une molécule de monomère en un temps très bref (de l'ordre de 10-5 s) et donne naissance à un nouveau centre actif.
Parmi les monomères susceptibles de polymériser par polymérisation en chaîne, figurent:
- les monomères contenant des liaisons insaturés
- carbone - carbone : alcènes (vinyle), alcynes
- carbone - oxygène : aldéhydes, cétones
- les hétérocycles : éthers cycliques, lactames. Dans ce cas la polymérisation s'effectue par ouverture de cycle.
De plus, ce sont les acides nucléiques qui polymérisent en chaîne (réaction en chaîne par polymérase) pour former la molécule d'ADN.
Aspect thermodynamique
Soit la réaction de propagation (voir plus bas), notée:
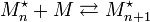
On peut lui attribuer la constante d'équilibre thermodynamique:
![K_{equ} = \frac {[M_{n+1}^\star]}{[M_{n}^\star].[M_{equ}]} \approx \frac {1}{[M_{equ}]}](https://static.techno-science.net/illustration/Definitions/autres/4/438ee175fe3607329630a2480acae7d4_12081b0772eae6ac4d565630ea6feb7f.png)
On sait:
A l'équilibre,
où Tpl est la température plafond, c'est-à-dire la température limite pour que la polymérisation l'emporte sur la dépolymérisation (car il faut ΔG < 0)
.
On en tire la température plafond:
![T{pl} = \frac {\Delta H^0} {\Delta S^0 + R.ln([M_{equ}])}](https://static.techno-science.net/illustration/Definitions/autres/4/4f35e105dd59ccadff628c15702d1c49_e58ead62b53a577ccd357c4688cd39af.png)
Si cette température (calculable en utilisant des tables) est trop basse, cela peut poser problème expérimentalement.
Classification
Selon la nature du centre actif, on peut classer toute polymérisation en chaîne en :
- polymérisation radicalaire : amorçage par peroxydes... (source de radicaux libres),
- polymérisation cationique : amorçage par cation H+... (source de carbocations),
- polymérisation anionique : amorçage par anion Y- (source de carbanions),
- polymérisation coordinative : amorçage par un complexe des métaux de transition.
Polymérisation ionique
La polymérisation en chaîne par voie radicalaire ne permet pas un contrôle de linéarité des chaînes. C'est pourquoi on s'est tourné vers les polymérisations ioniques (cationiques ou anioniques) dès les années 1950.
La première étape est toujours l'amorçage, mais avec désormais une rupture hétérolytique, d'où le nom de polymérisation ionique. Selon la polarité du milieu, l'amorceur peut donner naissance à une paire d'ions (cas d'un milieu de faible constante diélectrique) ou à des ions libres solvatés (milieu dissociant). Ensuite vient la propagation bien plus rapide que par mode radicalaire (facteur de 103 à 106). La croissance se fait par insertion du monomère dans l'ion libre ou la paire d'ions. La différence essentielle avec le mode radicalaire se situe au niveau de la terminaison. En effet les espèces ioniques actives ne réagissent pas entre elles. En l'absence d'échanges avec un solvant, les réactions de terminaison sont très lentes ou inexistantes en polymérisation ionique.