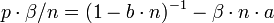Pression cinétique - Définition
La liste des auteurs de cet article est disponible ici.
Longueur de Loschmidt
La longueur de Loschmidt est la distance moyenne séparant deux molécules dans les conditions normales de pression et de température ; elle est définie comme étant la racine cubique du volume libre moyen autour d'une molécule. Cette longueur est indépendante du gaz parfait considéré, et vaut
- d = 333 pm.
Voir l'article Gaz parfait.
Équation d'état du viriel
Le paragraphe correction de covolume a indiqué :
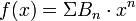
dans le cas d'un gaz de boules dures, les calculs ultérieurs montreront que :
- f(x) = 1 + 4x + 10x2 + 18,3648x3 + 28,24x4 + 39,53x5 + ...
Les 4 premiers termes sont analytiques, les deux suivants sont numériques (calcul d'intégrales par la méthode de Monte-Carlo).
Or la série suivante :
1 + 4x + 10x2 + 18x3 + 28x4 + 40x5 + 54x6 + 70x7 + O(x8),x,8
montre que :

Or cela indique une asymptote pour x = 1, alors que, évidemment, on ne saurait dépasser la compacité maximale de Pi/sqrt(18). Cela limite la portée de ce calcul et l'on verra comment l'améliorer dans un paragraphe ultérieur.
calcul de B2 = 4
calcul de B3 = 10
calcul de B4 = 18,36.
calcul de Bn
expression de B2, B3 et B4
Le calcul de la fonction de partition(en mécanique classique) donne les résultats suivants :
La pression interne de Van der Waals
Van der Waals, s'appuyant sur les travaux de Laplace, a compris le rôle que jouait l'attraction entre 2 particules du gaz (attraction qui porte aujourd'hui son nom). En moyenne, une particule située à grande distance de la paroi ne ressent qu'une force moyenne NULLE. Par contre, une particule allant vers la paroi est décélérée par cette attraction, multiple de la densité : donc l'énergie cinétique d'impact sera réduite d'un facteur F.L.N/V. Et pour la pression due à l'ensemble des particules, il y aura donc une réduction d'un facteur (N/V)^2:
L'ensemble de ces considérations amenèrent Van der Waals à sa célèbre équation :
ou encore :
Il ne faut pas croire la pression interne comme négligeable, car elle varie considérablement. Donnons-en une évaluation :
Soit de l'eau liquide en équilibre à 473K avec sa vapeur :pour le liquide NkT/V est très grande : 55000/22.4 (473/373)~2000 bars , donc la pression interne, 2000-1, aussi . mais pour la vapeur , elle sera environ 1/10^6 fois plus faible , soit 1/1000 bar et donc négligeable.
Autres équations d'état
Percus-Yevick , Redlich-Kwong , facteur acentrique...
![B_2 = - (1/2V^2)\int \int dv_1 dv_2 f(1,2) \cdot[4V/bo]](https://static.techno-science.net/illustration/Definitions/autres/d/dae8c60045aa11f2f9390ae5ce4e7b93_6a5650c95d027874923941fab713d666.png)
![B_3 = \cdot[4V/bo]^2](https://static.techno-science.net/illustration/Definitions/autres/6/60b70ee1e58d1212db3b557200d4e6cc_34eb71ca8ad2fb11cdf70f8c62ff61f6.png)
![B_4 = \cdot[4V/bo]^3](https://static.techno-science.net/illustration/Definitions/autres/9/9c69c51672e79f90d7810a7e37fdb4a1_0674e13346872cca63cbdd34053ccd53.png)