Trioxyde de soufre - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Trioxyde de soufre | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | anhydride sulfurique | |
| No CAS | ||
| No EINECS | ||
| Apparence | liquide fumant, hygroscopique, incolore oucristaux incolores a blancs. | |
| Propriétés chimiques | ||
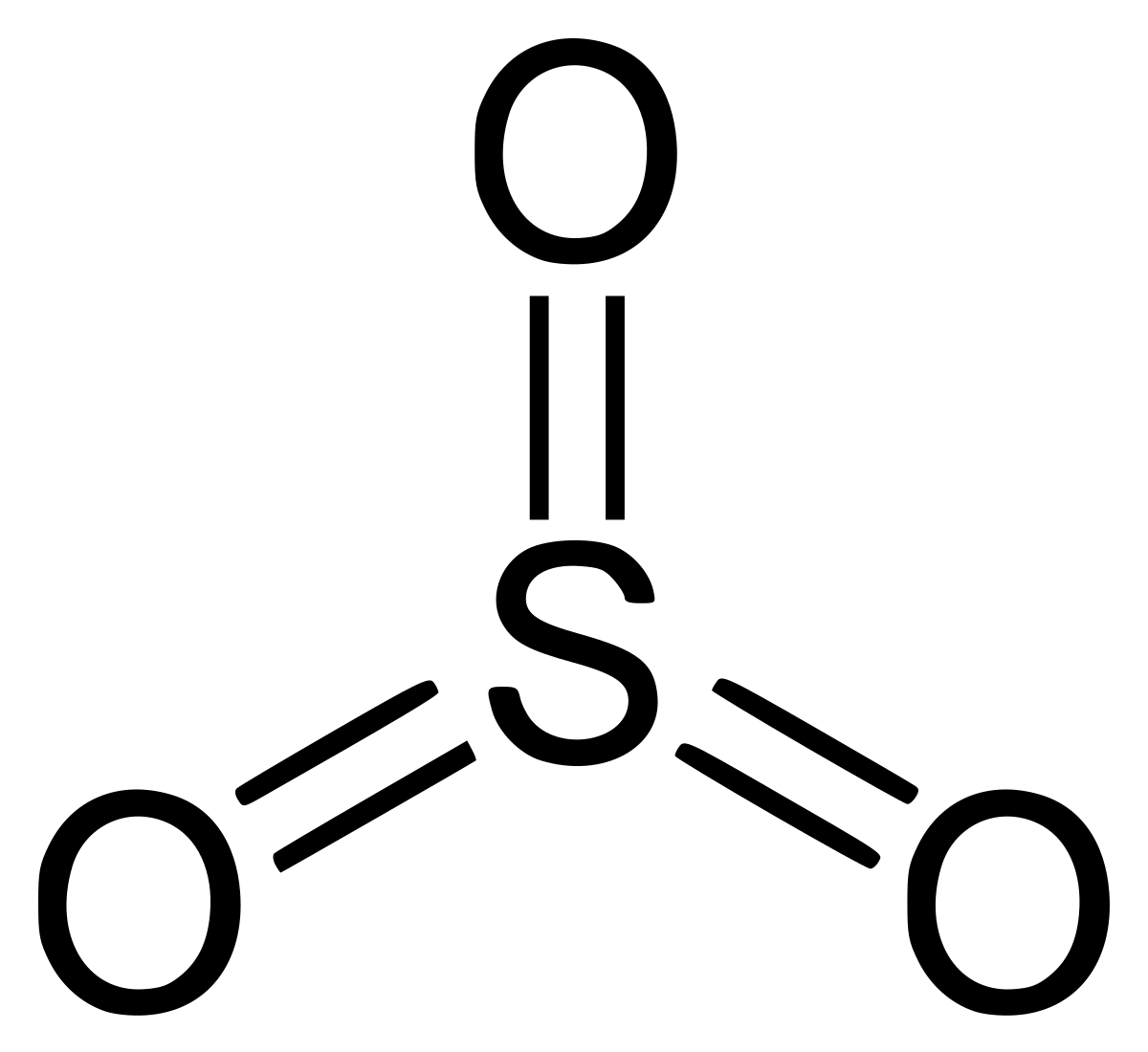
| Formule brute | SO3 | |
| Masse molaire | 80,063 ± 0,006 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 16,9 °C | |
| T° ébullition | 45 °C | |
| Solubilité | dans l'eau : réaction | |
| Masse volumique | 1,9 g·cm-3 | |
| Pression de vapeur saturante | ||
| Point critique | 82,1 bar, 217,85 °C | |
| Thermochimie | ||
| S0 | 256,77 J/mol·K | |
| ΔH0 | -397,77 kJ/mol | |
| ΔH° | 40,69 kJ·mol-1 (1 atm, 44,5 °C); 43,14 kJ·mol-1 (1 atm, 25 °C) | |
| Cp | 24,02 J/mol·K | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,82 ± 0,03 eV (gaz) | |
| Précautions | ||
| | ||
| ||
| Phrases R : 14, 34, | ||
| Phrases S : 8, 25, 36/37/39, 45, | ||
| | ||
| Produit non classifié | ||
| | ||
Le trioxyde de soufre a pour formule chimique SO3.
Le trioxyde de soufre est un liquide, de densité 1,92 g·cm-3, de point d'ébullition +43,7 °C, et de point de fusion +16,8 °C.
Il peut être obtenu par synthèse industrielle grâce à l'oxydation du dioxyde de soufre par l'oxygène de l'air :
- 2SO2 + O2 = 2SO3
Mélangé à de l'eau, il produit de l'acide sulfurique (H2SO4) :
- SO3 + H2O = H2SO4 (+ 88 kJ)
qui, en chauffant, bout à ~290 °C, et se redécompose en trioxyde de soufre et en eau à 340 °C.
Formation
De grandes quantités de dioxyde de soufre (SO2) sont produites en brûlant du soufre au cours de la fabrication de l’acide sulfurique. Sous l’action d’un catalyseur, ces molécules se recombinent à un autre atome d’oxygène, en sorte que la plus grande partie du dioxyde de soufre fabriqué est transformé en trioxyde de soufre. Cette transformation est très lente en l’absence de catalyseur, comme c’est le cas, dans les goutellettes d’eau, lorsque le dioxyde de soufre atmosphérique devient du trioxyde de soufre s'hydratant en acide sulfurique, composant des pluies acides.