Anhydride maléique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Anhydride maléique | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | 2,5-Furanedione | ||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | cristaux incolores ou blancs, d'odeur âcre. | ||
| Propriétés chimiques | |||
| Formule brute | C4H2O3 | ||
| Masse molaire | 98,0569 ± 0,0042 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 53 °C | ||
| T° ébullition | 202 °C | ||
| Solubilité | dans l'eau : 400 g·l-1 | ||
| Masse volumique | 1,5, 1,3 (liquide à 70 °C) | ||
| T° d’auto-inflammation | 475 °C | ||
| Point d’éclair | 102 °C (coupelle fermée) | ||
| Limites d’explosivité dans l’air | 1,4–7,1 %vol | ||
| Pression de vapeur saturante | 20 Pa à 20 °C 25 Pa à 25 °C 45 Pa à 30 °C 200 Pa à 50 °C | ||
| Thermochimie | |||
| Cp | |||
| Précautions | |||
| | |||
| |||
| Phrases R : 22, 34, 42/43, | |||
| Phrases S : (2), 22, 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
1 3 1 | |||
| | |||


| |||
| | |||

Danger | |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,25 ppm haut : 0,32 ppm | ||
| | |||
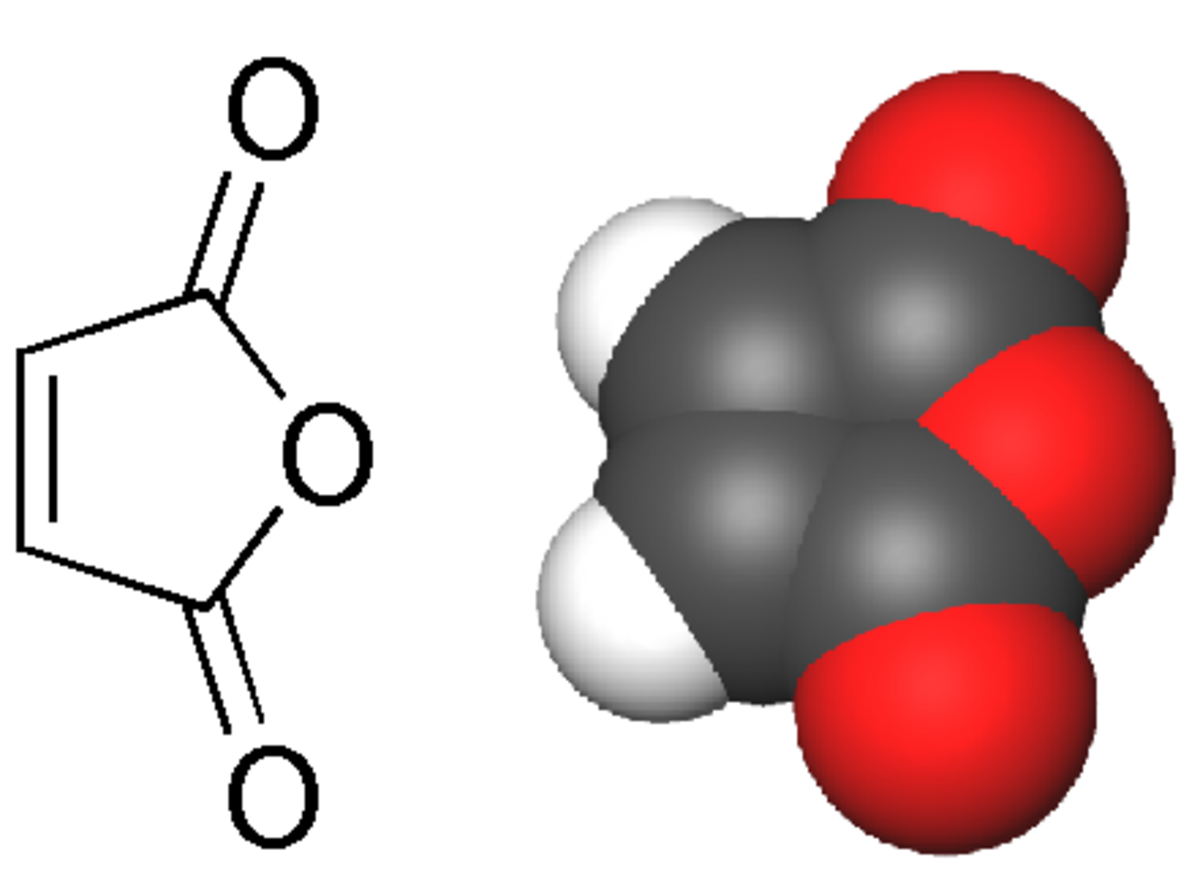
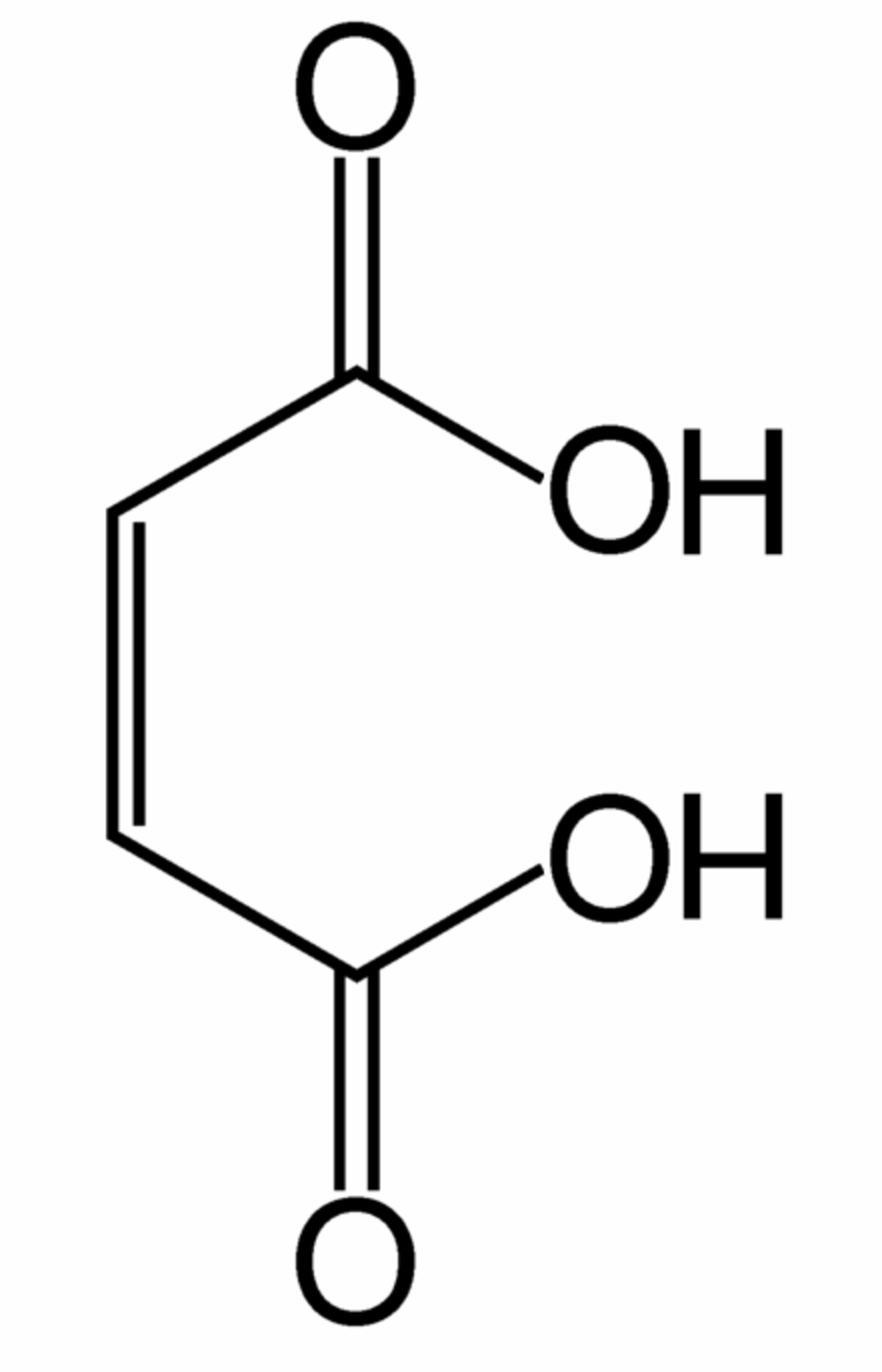
L'anhydride maléique (anhydride cis-butènedioïque) est l'anhydride de l'acide maléique (acide carboxylique):
Il se présente généralement sous la forme de cristaux blancs à transparents.
Production et synthèse
Comme son nom l'indique, l'anhydride maléique peut être obtenu par déshydratation de l'acide maléique (hydraté, il donne l'acide maléique). Il a longtemps été synthétisé par oxydation du benzène ou d'autres composés aromatiques. De par l'augmentation ces dernières années du prix du benzène (et de par sa toxicité), il est aujourd'hui majoritairement synthétisé par oxydation du butane :
Réaction
L'anhydride maléique possède plusieurs propriétés chimiques remarquables dues aux fonctions qu'il présente. Il est entre autres utilisé :
- Pour obtenir l'acide maléique par hydratation. En utilisant à la place de l'eau un alcool, un ester peut être obtenu.
- Comme diénophile dans la réaction de Diels-Alder.
- Comme liguant dans des complexes métalliques (Pt(PPh3)2(AM) ou Fe(CO)4(AM))
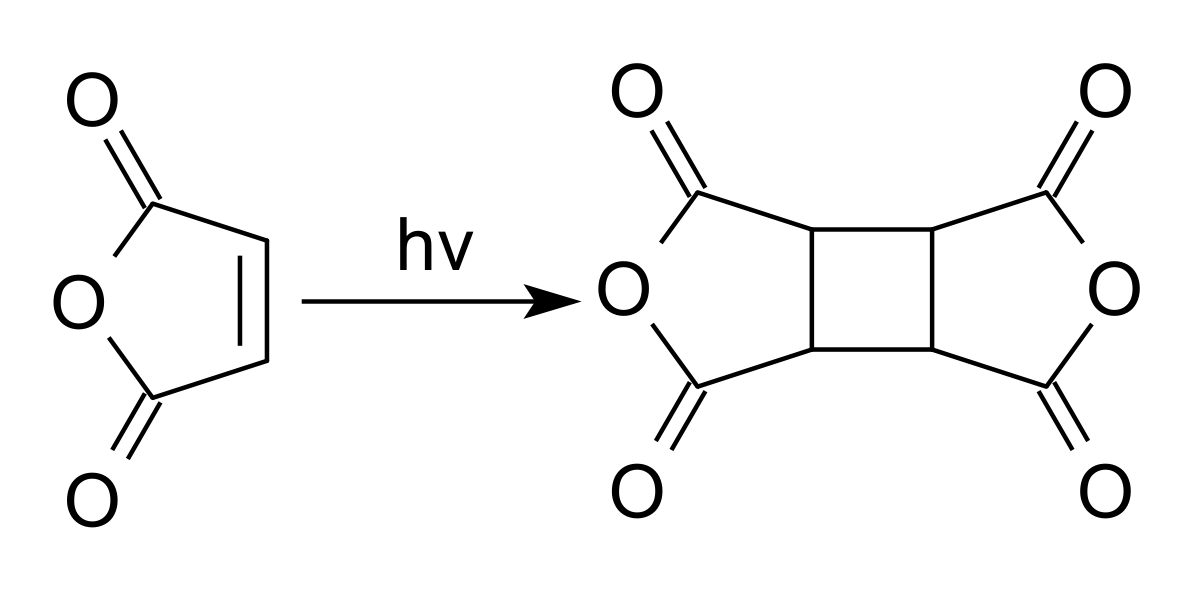
L'anhydride maléique se dimérise lors d'une réaction photochimique en "dianhydride cyclobutanetétracarboxylique", CBTA. Ce composé est utilisé dans la production de polyimides et comme un film d'alignement pour les écrans à cristaux liquides