Acide maléique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide maléique | |||
|---|---|---|---|
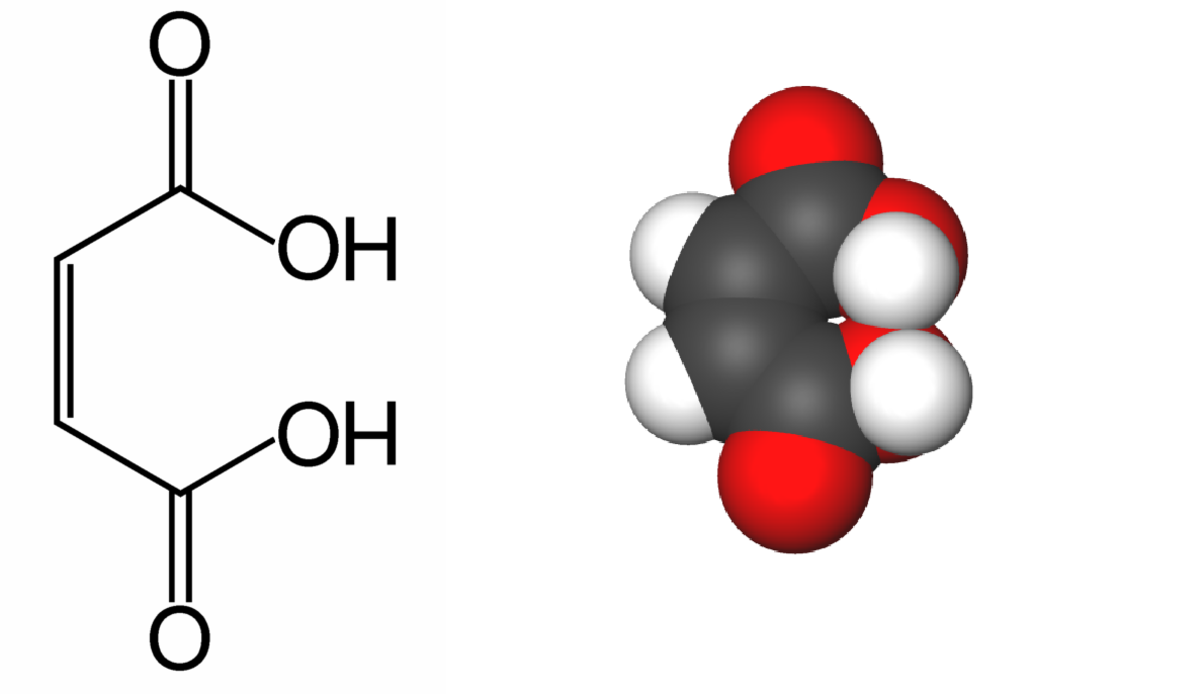
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | acide Z-butènedioïque, acide maléique | ||
| No CAS | |||
| No EINECS | |||
| DrugBank | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | cristaux blancs | ||
| Propriétés chimiques | |||
| Formule brute | C4H4O4 | ||
| Masse molaire | 116,0722 ± 0,0047 g·mol-1 | ||
| pKa | pKa1: 1,83 - pKa2: 6,07 | ||
| Propriétés physiques | |||
| T° fusion | 131 °C | ||
| T° ébullition | Se décompose au-dessous du point d'ébullition à 135 °C | ||
| Solubilité | dans l'eau à 25 °C : 780 g·l-1 | ||
| Masse volumique | 1,5920 g·cm-3 | ||
| Point d’éclair | 127 °C | ||
| Pression de vapeur saturante | < 0,1 mbar à 20 °C | ||
| Thermochimie | |||
| ΔH0 | -787 kJ/mol | ||
| ΔH0 | -791 kJ/mol | ||
| Cp | 136 J/mol.K (21 °C) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 22, 36/37/38, | |||
| Phrases S : (2), 26, 28, 37, | |||
| | |||
| |||
| | |||
| Produit non classifié | |||
| | |||

Attention | |||
| Écotoxicologie | |||
| LogP | -0,5 | ||
| | |||
L'acide maléique est un diacide carboxylique, l'acide Z-butènedioïque. Cette molécule est le diastéréoisomère de l'acide fumarique ou acide E-butènedioïque, la configuration montre que les groupements carboxyles, caractéristiques des acides organiques sont placés sur un plan du même côté de la liaison éthylénique, c'est-à-dire de la double liaison carbone-carbone, rigide.
Les sels de ses anions et les esters sont appelés maléates.
Stabilité et propriétés
L'acide maléique est moins stable que son isomère fumarique, car la proximité des groupements carboxyles rend aisée une deshydratation en anhydride maléique, découverte par le chimiste Kekulé.
La première acidité est relativement forte, par un effet de stabilisation électronique de la base conjuguée.
L'acide maléique est un philodiène par sa liaison éthylénique, appauvrie par deux groupes voisins attracteurs d'électrons. Ce philodiène participe ainsi à de nombreuses réactions avec des diènes pour former des cycles à 6 carbones.
Il donne facilement par chauffage un anhydride cyclique appelé anhydride maléique. C'est la réaction de deshydratation évoquée plus haut, qui explique le non sens de la mesure de point de fusion ou d'ébullition, signalé par le terme décomposition, puisque la molécule d'acide maléique se transforme en anhydride cyclique beaucoup plus volatile.
L'acide maléique, par sa double liaison susceptible de réaction d'addition radicalaire, est aussi un monomère. Associé à l'acide acrylique, il permet d'obtenir des copolymères acrylomaléiques, qui présentent malgré un coût élevé un intérêt en tant qu'adjuvant actifs de détergents. Leurs effets dispersants, sequestrants et légèrement tensio-actifs les proposent pour l'usage adjuvant en substitution des polyphosphates, en l'occurrence le tripolyphosphate de sodium STPP ou Na5P3O10.


















































