Aziridine - Définition
La liste des auteurs de cet article est disponible ici.
Sécurité
La toxicologie de chaque aziridine spécifique dépend de sa propre structure et activité qui participe des caractéristiques générales du groupe des aziridines. Etant électrophile, les aziridines sont susceptibles d'attaquer et de voir leur cycle ouvert par des nucléophiles endogènes tels que les bases azotées de l'ADN ce qui correspond à un potentiel mutagène.
Ainsi inhalation et contact direct avec les aziridines sont proscrits. Certains rapports notent que même des gants utilisés normalement en chimie ne préviennent pas l'infiltration cutanée des aziridines. Il est donc important que les utilisateurs vérifient les temps d'imprégnation des gants et fassent scrupuleusement attention au fait d'éviter la contamination lors du retrait des gants.
L' Agence internationale de recherche sur le cancer (IARC) a passé en revue les composés aziridines et les a classés comme carcinogène humain possible (Group 2B). En procédant à une évaluation globale, le groupe de travail IARC a pris en considération le fait que les aziridines sont des agents alkylants directs qui sont mutagènes dans une large gamme de systèmes d'essai et forment des adduits d'ADN qui sont promutagènes.
Les aziridines provoquent des effets irritants sur les muqueuses telles les yeux, le nez, le système respiratoire et même la peau. Les aziridines pénètrent rapidement à travers la peau en cas de contact. Elles peuvent causer des dermatoses allergiques et de l'urticaire ou donner un asthme occupationnel.
Caractéristiques physico-chimiques
Structure
Les angles des liaisons dans l'aziridine sont autour de 60 ° ce qui considérablement moins que l'angle de 109,5 ° normalement trouvé dans les hydrocarbures ou les amines linéaires et non contraints. Ces angles sont cependant comparables à ceux trouvés dans les cycles cyclopropane ou oxirane et correspondent aux mêmes contraintes angulaires dans le cycle : les liaisons dans ce type de cycle peuvent être expliquées en invoquant un modèle de liaison banane. L'aziridine est moins basique qu'une amine acyclique et aliphatique avec un pKa de 7.9 pour l'acide conjugué ce qui est dû à un accroissement du caractère s dans la paire libre de l'azote. Les contraintes angulaires accrues dans l'aziridine sont aussi responsables de l'accroissement de la barrière d'énergie pour l'inversion de l'atome d'azote. Cette barrière est suffisamment haute dans les aziridines pour pouvoir séparer des invertomères comme les invertomères cis et trans de la N-chloro-2-méthylaziridine.
Réactions
Ouverture de cycle nucléophilique
Les aziridines sont des substrats sensibles aux réactions d'ouverture de cycle avec beaucoup de nucléophiles à cause des contraintes moléculaires dans le cycle. Alcoolyses et ammonialyses sont typiquement les réactions inverses des cyclisations. D'autres nucléophiles efficaces sont les carbones nucléophiles comme dans les réactifs organolithiens ou les organocuprates comme le réactif de Gilman.
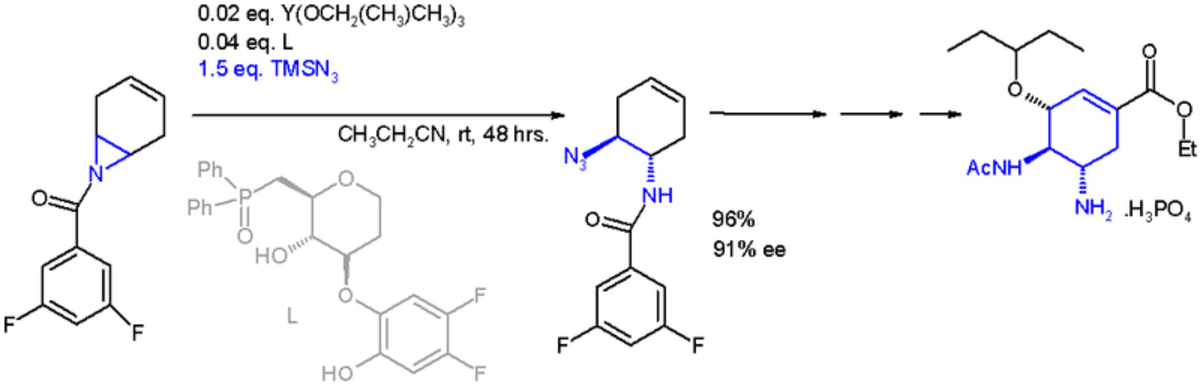
Une application importante d'une réaction d'ouverture de cycle en synthèse asymétrique est celle avec le triméthylsilylazoture TMSN3 et un ligand asymétrique:
Le catalyseur est construit sur l'yttrium et trois substituants isopropyloxy, le ligand est une phosphine oxyde. Avec un excès énantiomérique de 91% ee, cette réaction permet une synthèse totale de l'oseltamivir (en) (Tamiflu®).
Autres réactions
Les aziridines non N-substituées peuvent être ouvertes par des alcènes en présence d'un acide de Lewis fort comme B(C6F5)3 Certaines aziridines N-substituées et avec des groupes attracteurs d'électron sur les deux atomes de carbone forment des azométhine ylures par une réaction électrocyclique d'ouverture de cycle. Ces ylures peuvent être piégés avec un dipolarophile idoine par une cycloaddition 1,3-dipolaire.