Aziridine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Aziridine | ||||
|---|---|---|---|---|
| Général | ||||
| Nom IUPAC | ||||
| Synonymes | azacyclopropane éthylènimine diméthylènimine | |||
| No CAS | ||||
| No EINECS | ||||
| PubChem | ||||
| ChEBI | ||||
| SMILES | ||||
| InChI | ||||
| Apparence | liquide huileux incolore et clair | |||
| Propriétés chimiques | ||||
| Formule brute | C2H5N | |||
| Masse molaire | 43,0678 ± 0,0022 g·mol-1 | |||
| Moment dipolaire | 1,90 ± 0,01 D | |||
| Propriétés physiques | ||||
| T° fusion | 195,15 °C | |||
| T° ébullition | 56 °C | |||
| Masse volumique | 0,8321 g·cm-3 à 20 °C | |||
| T° d’auto-inflammation | 320 °C | |||
| Point d’éclair | -13 °C | |||
| Limites d’explosivité dans l’air | 3,6–46 %vol 64–820 g·cm-3 | |||
| Pression de vapeur saturante | 213 mbar à 20 °C 333 mbar à 30 °C 780 mbar à 50 °C | |||
| Thermochimie | ||||
| ΔH0 | 91,9 kJ·mol-1 | |||
| Cp | ||||
| PCI | -1 591,36 kJ·mol-1 | |||
| Précautions | ||||
| | ||||
| ||||
| Phrases R : 11, 26/27/28, 34, 45, 46, 51/53, | ||||
| Phrases S : 45, 53, 61, | ||||
| | ||||
| ||||
| | ||||
|
3 4 3 | ||||
| | ||||


| ||||
| | ||||
| Groupe 2B : Peut-être cancérogène pour l'homme | ||||
| Écotoxicologie | ||||
| DL | 15 mg·kg-1 (rat, oral) 3,5 mg·kg-1 (rat, i.p.) 4 mg·kg-1 (souris, i.p.) | |||
| Seuil de l’odorat | bas : 2 ppm | |||
| | ||||
L'aziridine (n.f.) ou azacyclopropane est le composé organique cyclique de formule brute C2H5N. Elle est aussi le composé parent des aziridines et du groupe fonctionnel qui correspond à un hétérocycle à trois côtés composé d'une amine et de deux groupes méthylène .
Production et synthèse
Les aziridines peuvent être préparées en chimie organique de nombreuses façons.
Cyclisation d'haloamines et d'amino-alcools
Un groupe amine peut déplacer un halogénure adjacent (en β) dans une réaction de substitution nucléophile intramoléculaire pour former une aziridine. Les animo-alcools ont la même réactivité mais il faut tout d'abord convertir les groupes hydroxyde en meilleurs groupes partants, par exemple en tosylate. La cyclisation d'un animo-alcool est appelé synthèse de Wenker (1935) et une d'haloamine, la éthylènimine-méthode de Gabriel (1888)
Addition de nitrène
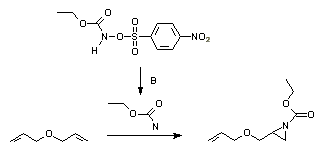
L'addition d'un nitrène sur un alcène est une méthode bien établie pour la synthèse des aziridines. Photolyses ou thermolyses d'azotures sont une bonne voie pour générer des nitrènes. Ceux-ci peuvent aussi être générés in-situ du diacétate d'iodosobenzène et des sulfamidés ou l'éthoxycarbonylnitrène d'un N-sulfonyloxy précurseur:
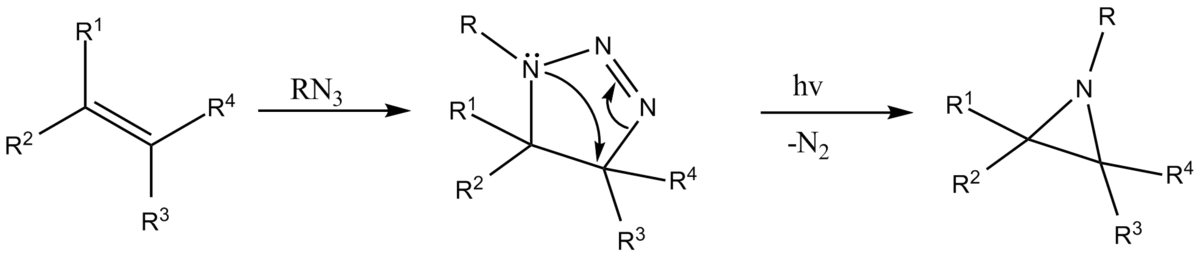
Décomposition de triazolines
Sous traitement thermique ou par photolyse d'une triazoline, de l'azote est expulsé et reste une aziridine. La triazoline requise est obtenue d'une réaction de cycloaddition d'un azoture sur un alcène.
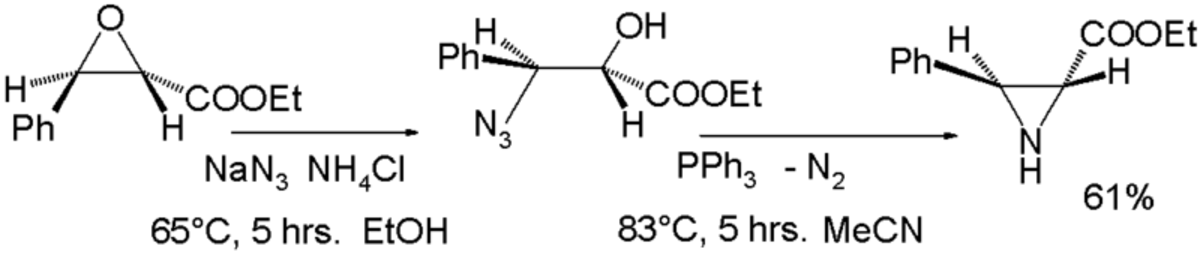
Via l'ouverture d'un époxyde
Une méthode consiste en une réaction d'ouverture de cycle d'un époxyde avec l'azoture de sodium suivie d'une réduction organique de l'azoture obtenu avec la triphénylphosphine par expulsion d'azote gazeux:
Une autre méthode consiste en la réaction d'ouverture d'un époxyde par une amine suivie de la refermeture du cycle par une réaction de Mitsunobu.
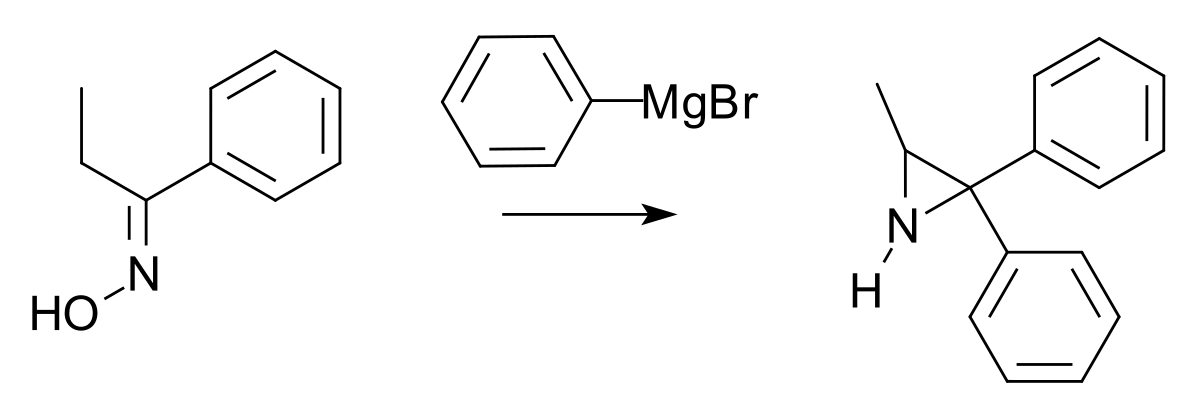
Réaction d'un oxime avec un réactif de Grignard
L'éthylènimine synthèse de Hoch-Campbell décrit la synthèse d'aziridines par la réaction de certains oximes avec des réactifs de Grignard: