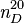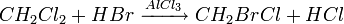Bromochlorométhane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Bromochlorométhane | |||
|---|---|---|---|
| Général | |||
| Nom IUPAC | |||
| Synonymes | Halon 1011 | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| ChEBI | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore à jaune | ||
| Propriétés chimiques | |||
| Formule brute | CH2BrCl | ||
| Masse molaire | 129,384 ± 0,004 g·mol-1 129,38 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 185,2 °C | ||
| T° ébullition | 341 °C | ||
| Solubilité | 9 g·l-1 (eau,20 °C) | ||
| Masse volumique | 1,9344 g·cm-3 à 20 °C | ||
| Pression de vapeur saturante | 147 mbar à 20 °C 250 mbar à 30 °C 530 mbar à 50 °C | ||
| Thermochimie | |||
| ΔH0 | -20,7 kJ·mol-1 | ||
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 20, 36/37/38, 59, | |||
| Phrases S : 26, 37/39, 59, | |||
| | |||
| |||
| | |||
|
1 1 0 | |||
| | |||

| |||
| Écotoxicologie | |||
| DL | 4,3 g·kg-1 (souris, oral) 5 g·kg-1 (rat, oral) | ||
| LogP | 1,41 | ||
| | |||
Le bromochlorométhane est hydrocarbure halogéné de formule brute CH2Cl1Br1. C'est un liquide qui a été utilisé comme moyen d'extinction dans les incendies et qui a été finalement remplacé par d'autres produits moins dangereux et avec un potentiel de destruction de la couche d'ozone plus faible.
Utilisation
Il a été utilisé dans les extincteurs à feu par les allemands dans les années quarante, qui tentaient de trouver une alternative moins toxique et plus efficace au tétrachlorométhane. C'était un problème dans les avions et les tanks où le tétrachlorométhane émettait des sous produits très toxiques quand on l'utilisait sur un feu. Le bromochlorométhane est quant à lui légèrement moins toxique et fut utilisé jusque dans les années soixante aux USA, avant d'être interdit par la NFPA en 1969, quand des agents plus efficaces et plus sûrs furent développés (bromochlorodifluorométhane et bromotrifluorométhane). En raison de son potentiel de déplétion ozonique non négligeable, sa production est interdite depuis le 1er janvier 2002 suite à une réunion des signataires du Protocole de Montréal à propos des substances néfastes pour la couche d'ozone.
Le bromochlorométhane peut être décomposé in vivo par une enzyme de la famille des hydrolases, selon la réaction suivante:
- CH2BrCl (l) + H2O (l) → CH2O (l) + 1/2 Br2 (l) + 1/2 Cl2 (g) + H2 (g)
Production et synthèse
Le bromochlorométhane peut être produit par un échange d'halogène à partir du dichlorométhane en présence de brome liquide ou gazeux:
L'addition de brome est contrôlé afin d'éviter une deuxième bromation qui conduirait à la formation du dibromométhane. Un réacteur est rempli avec des particules d'aluminium et une petite quantité de dichlorométhane. L'initiation de la réaction est lancée par l'adjonction de brome, puis le reste de dichlorométhane est ajouté avec le brome de manière contrôlée à 35 °C. Une fois l'opération terminée, le mélange réactionnel est distillé pour obtenir le produit bromé désiré. Environ 10% des produits bromés est du dibromométhane, le reste étant du bromochlorométhane.