Ozone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Ozone | ||||
|---|---|---|---|---|
| ||||
| Général | ||||
| Nom IUPAC | ||||
| Synonymes | ozone | |||
| No CAS | ||||
| No EINECS | ||||
| SMILES | ||||
| InChI | ||||
| Apparence | gaz incolore ou bleuatre, d'odeur caracteristique. | |||
| Propriétés chimiques | ||||
| Formule brute | O3 | |||
| Masse molaire | 47,9982 ± 0,0009 g·mol-1 | |||
| Moment dipolaire | 0,53373 D | |||
| Propriétés physiques | ||||
| T° fusion | -192,5 °C | |||
| T° ébullition | -111,9 °C | |||
| Solubilité | dans l'eau à 0 °C : 1 g·l-1 | |||
| Masse volumique | 2,144 g·l-1 (0 °C) | |||
| Point critique | 55,7 bar, -12,05 °C | |||
| Thermochimie | ||||
| ΔH0 | 142,67 kJ·mol-1 | |||
| Propriétés électroniques | ||||
| 1re énergie d'ionisation | 12,43 eV (gaz) | |||
| Précautions | ||||
| | ||||
| ||||
| | ||||




| ||||
| Écotoxicologie | ||||
| Seuil de l’odorat | bas : 0,0076 ppm haut : 0,03 ppm | |||
| | ||||
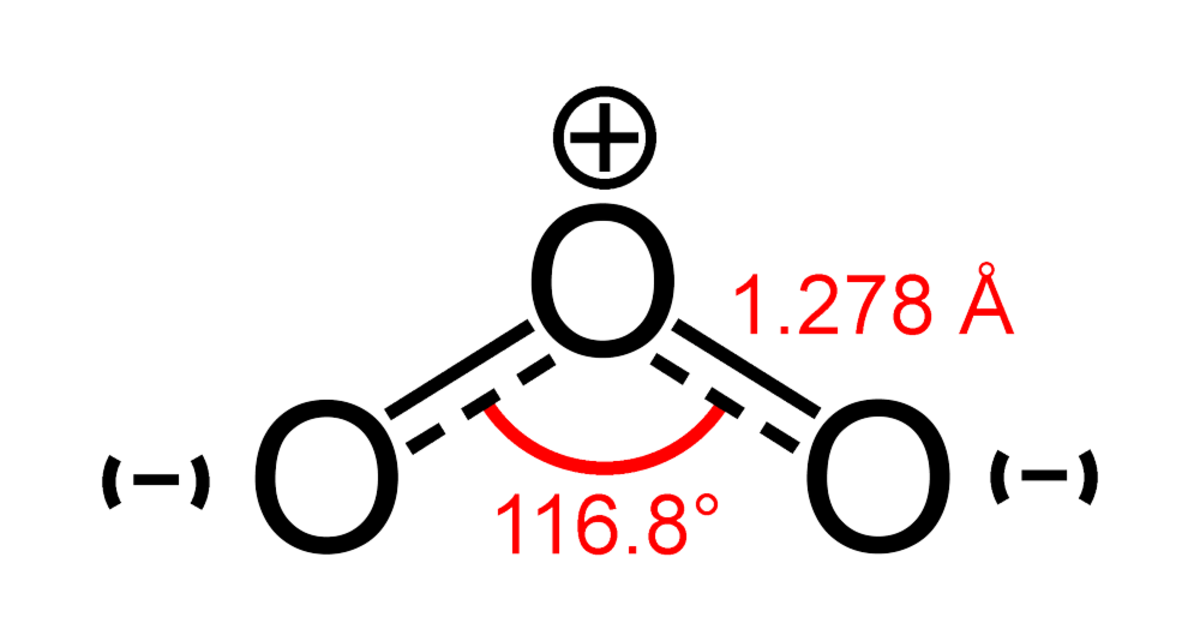
L’ozone (ou trioxygène) est un composé chimique comportant 3 atomes d’oxygène (O). Sa structure est une résonance entre trois états. Métastable aux conditions ambiantes, l’ozone a tendance à se décomposer naturellement en dioxygène. À température ambiante, c’est un gaz bleu pâle.
Il se liquéfie à -111,9 °C sous forme d’un liquide bleu foncé et se solidifie à -192,5 °C en un solide pourpre. Lorsqu'il est présent en densité élevée (par rapport au gaz), dans ses phases condensées, son instabilité se manifeste par une tendance à l'explosivité de ces phases.
Chimie
L'ozone est produit par décharge électrique dans du dioxygène. Il réagit avec les métaux alcalins et métaux alcalino-terreux pour former des ozonides (
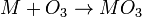
Contrairement au dioxygène inodore, l’ozone est perçu par l’odorat humain ; son odeur caractéristique qui rappelle l'eau de Javel est perceptible dans les endroits confinés où règne un champ électrique important (transformateur haute tension, échelle de Jacob, tubes UV, allume gaz). Respiré en grande quantité, il est toxique et provoque la toux.
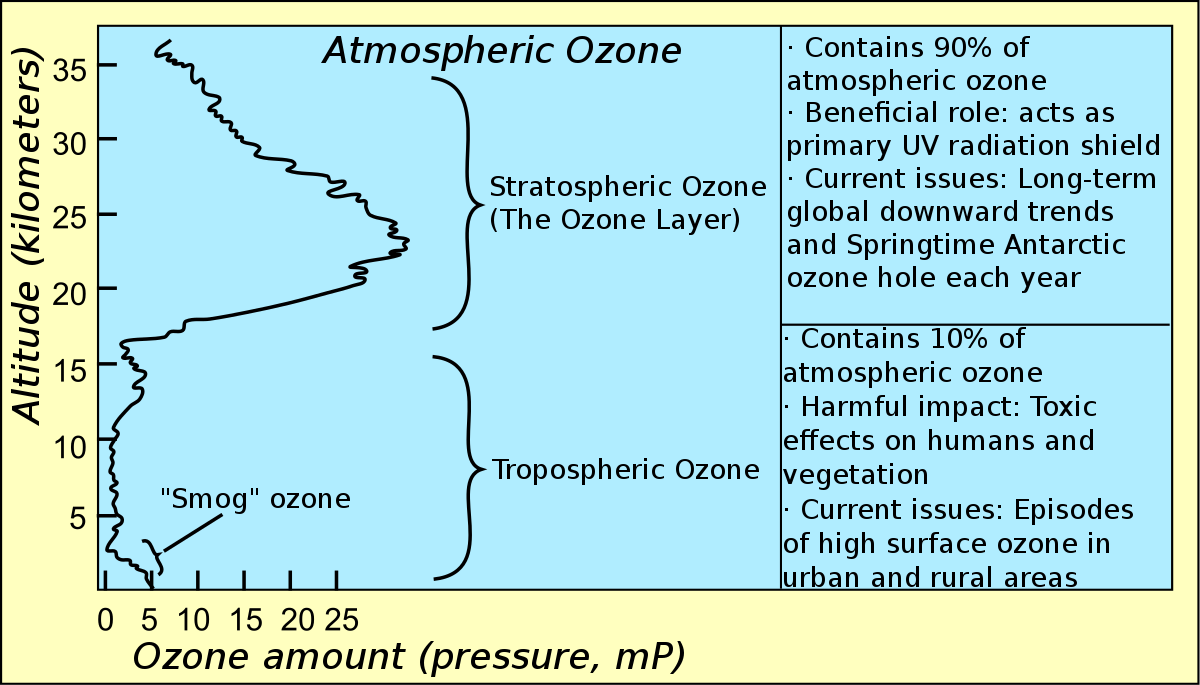
Dans l'atmosphère
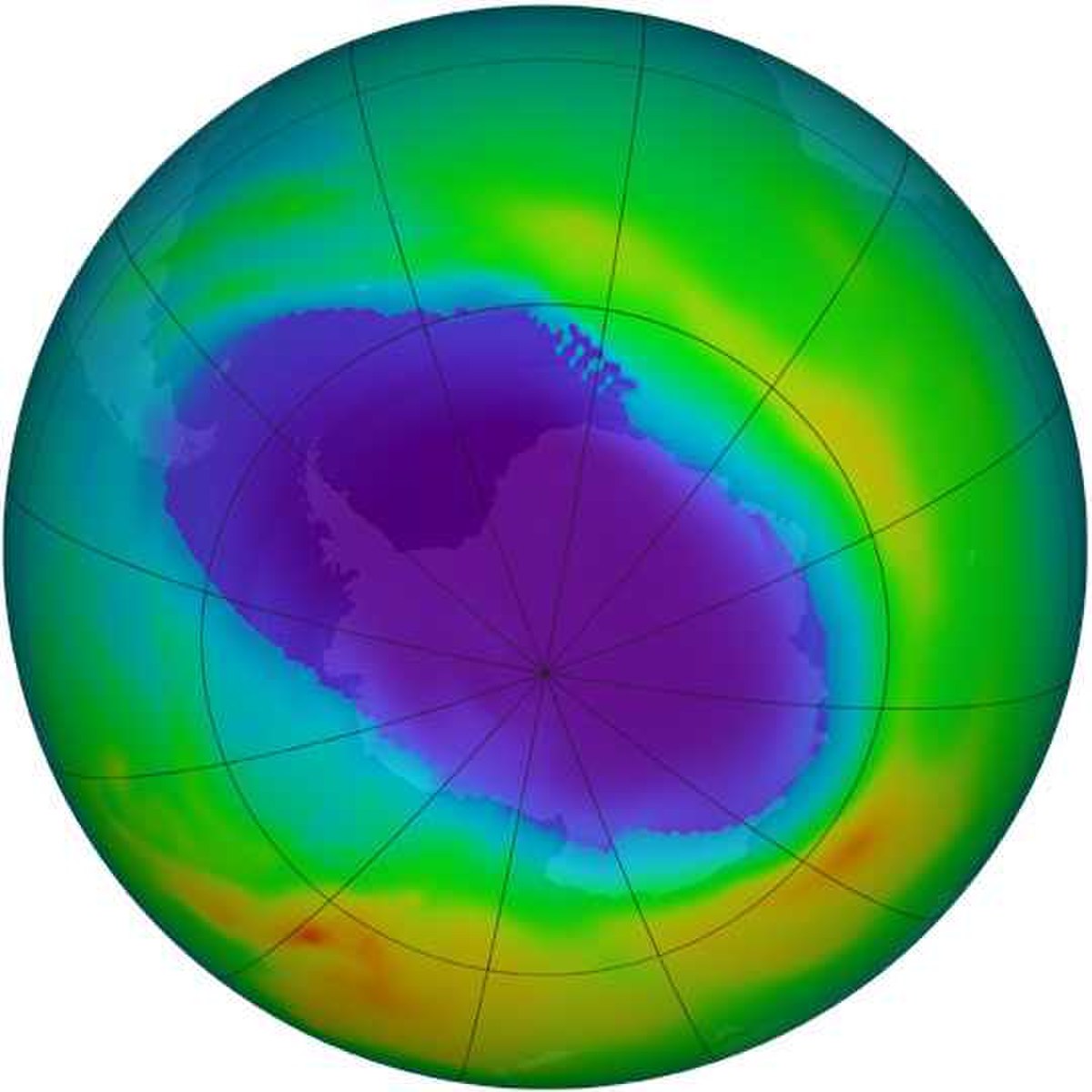
Dans la haute atmosphère terrestre, la couche d’ozone est une concentration d’ozone qui filtre une partie des rayons ultraviolets émis par le Soleil, ultraviolets notamment responsables de cancers de la peau. Cette couche protectrice est menacée par la pollution, en particulier par les émissions de gaz CFC (Chlorofluorocarbone), qui montent dans la haute atmosphère et y catalysent la destruction de l’ozone en le transformant en dioxygène, étant ainsi à l’origine du trou dans la couche d’ozone. Comme instrument de mesure, on peut noter l’instrument GOMOS du satellite ENVISAT.
L’ozone est aussi très présent autour des grandes agglomérations où sont produits des polluants qui sont ses précurseurs, notamment le dioxyde d’azote NO2, par leur pollution atmosphérique. Lors des canicules, on trouve l’ozone en grandes quantités dans les basses couches de l’atmosphère, surtout autour des centres urbains. Il y est principalement produit par la réaction des hydrocarbures imbrûlés et des oxydes d’azote des gaz d’échappement des véhicules avec l’oxygène de l’air sous l’influence de la lumière solaire. De même, les incendies de forêt en sont aussi une source importante, à partir des hydrocarbures et des oxydes d’azote qu'ils libèrent. Sous le vent de ces feux, sur de longues distances, les taux d'ozone peuvent tripler et dépasser les seuils recommandés. Lors de fortes températures, la dispersion de l'ozone vers les couches supérieures de l’atmosphère est freinée, induisant éventuellement des problèmes de santé chez les personnes fragiles.
L'ozone est en outre produit avec les éclairs de l'orage ainsi que, plus généralement, à partir de toute étincelle ou arc électrique. Photocopieuses et imprimantes laser ou moteurs électriques dégagent de l'ozone, pouvant conduire à des concentrations significatives dans un local mal ventilé.
Dans la nature, en cas de canicule ou forte insolation, les arbres émettent de l'Isoprène qui interagit avec l'ozone, et contribue à produire des aérosols, brumes et nuages protégeant les arbres d'un stress climatique excessif.