Catalyseur de Grubbs - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
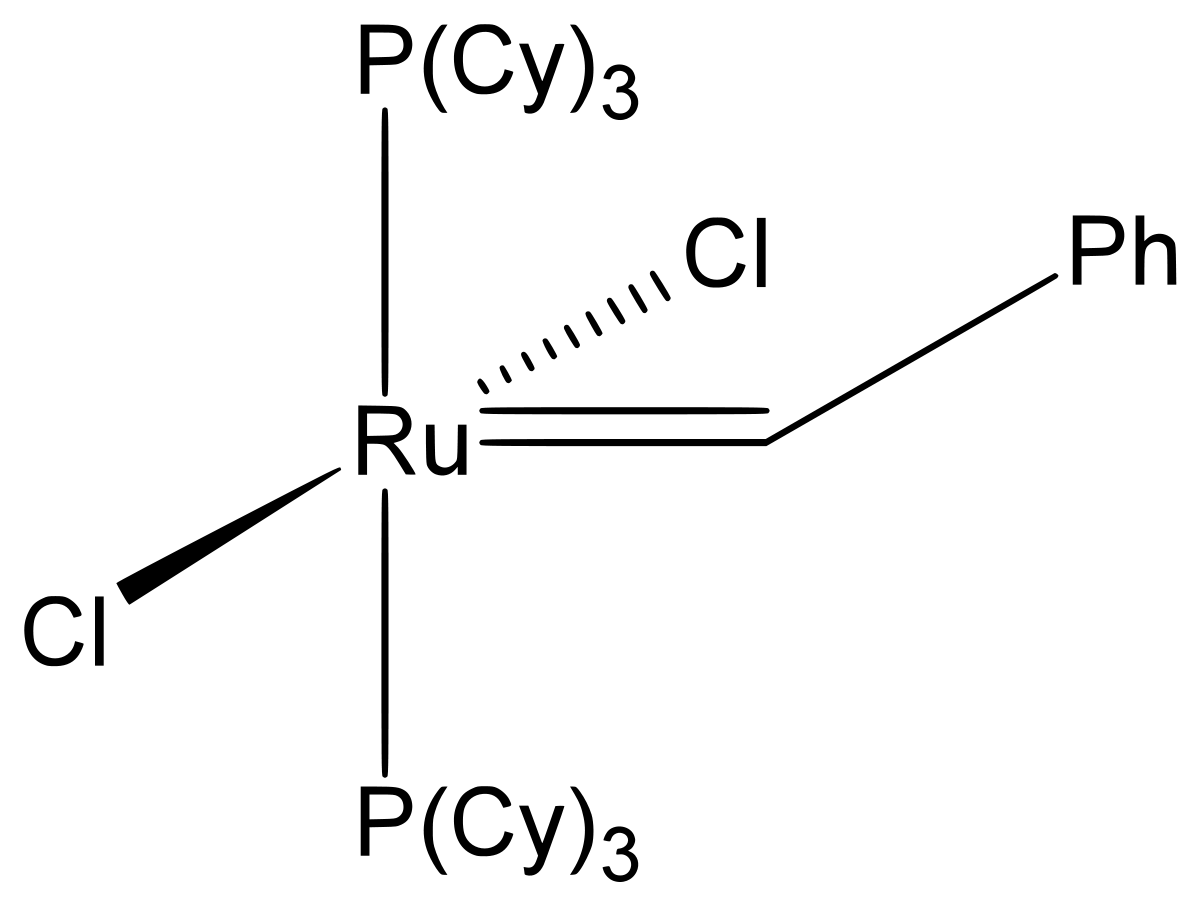
| Catalyseur de Grubbs de 1re génération | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
| No CAS | |
| Propriétés chimiques | |
| Formule brute | C43H72Cl2P2Ru |
| Masse molaire | 822,96 ± 0,06 g·mol-1 |
| Propriétés physiques | |
| T° fusion | 153 °C |
| | |
| Catalyseur de Grubbs de 2e génération | |
|---|---|
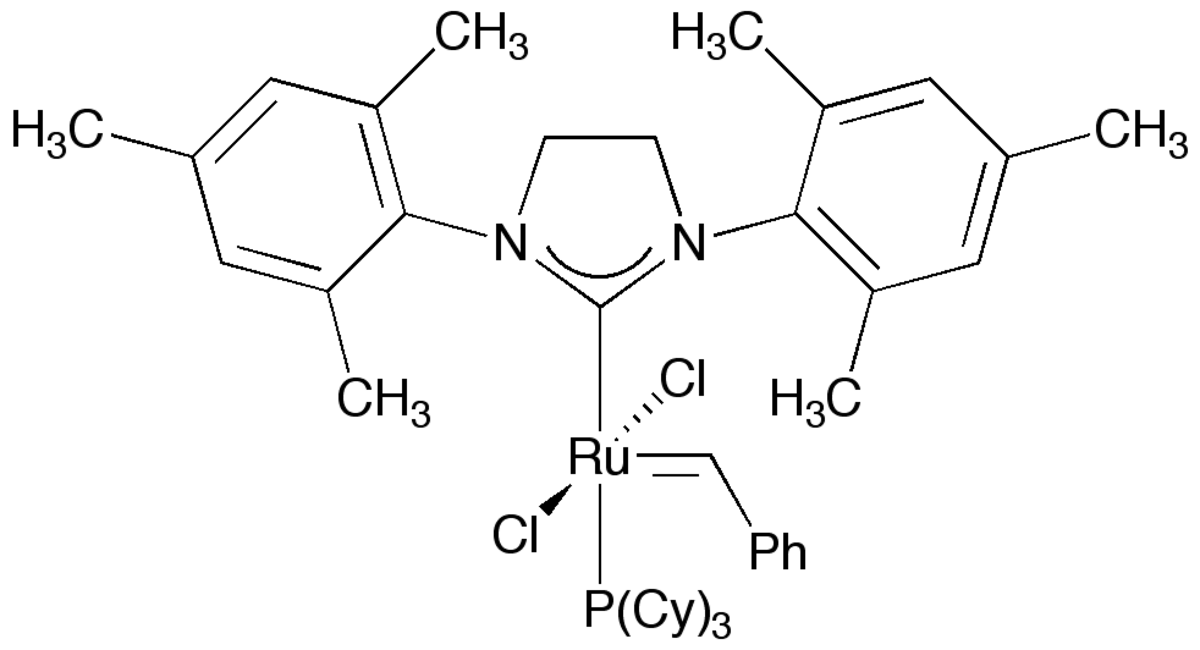
| |
| Général | |
| Nom IUPAC | |
| No CAS | |
| Propriétés chimiques | |
| Formule brute | C46H65Cl2N2PRu |
| Masse molaire | 848,97 ± 0,07 g·mol-1 |
| Propriétés physiques | |
| T° fusion | 143,5–148,5 °C |
| | |
Un catalyseur de Grubbs est un complexe métal de transition-carbène qui doit son nom à Robert Grubbs, le premier à les avoir synthétisés. Il existe plusieurs générations de ce catalyseur (les deux premières sont détaillées à droite). Contrairement aux autres catalyseurs utilisés dans la métathèse des oléfines, le catalyseur de Grubbs tolère la présence d'autres groupements fonctionnels et peut être utilisé dans de nombreux solvants. C'est pour cela que ce catalyseur est abondamment employé.
Première génération
La première génération de ce catalyseur a été abondamment utilisé en synthèse organique pour réaliser des métathèses croisées d'oléfines, des métathèses et polymérisations par ouverture de cycle (ROMP), des métathèses et polymérisations de diènes acycliques (ADMET) et des fermetures de cycle par métathèse. Il est aisément obtenu à partir de RuCl2(PPh3)3, de phényldiazométhane et de tricyclohexylphosphine par une synthèse tout-en-un. Le catalyseur de Grubbs est un composé relativement stable à l'air (contrairement au catalyseur de Schrock), ce qui permet des manipulations aisées. La dénomination IUPAC de ce composé est : benzylidène-bis(tricyclohexylphosphine)dichlororuthénium.
La formation de l'isomère cis ou de l'isomère trans à la fin de la métathèse dépend d'une part de la géométrie de la coordination entre le catalyseur et le substrat et de la gène stérique autour de la double liaison nouvellement formée.
Catalyseur d'Hoveyda-Grubbs
Dans cette version du catalyseur de Grubbs, l'une des phosphines est remplacée par un groupe isopropyloxy lié au cycle benzénique. La deuxième génération du catalyseur d'Hoveyda-Grubbs remplace également la deuxième phosphine par un NHC.
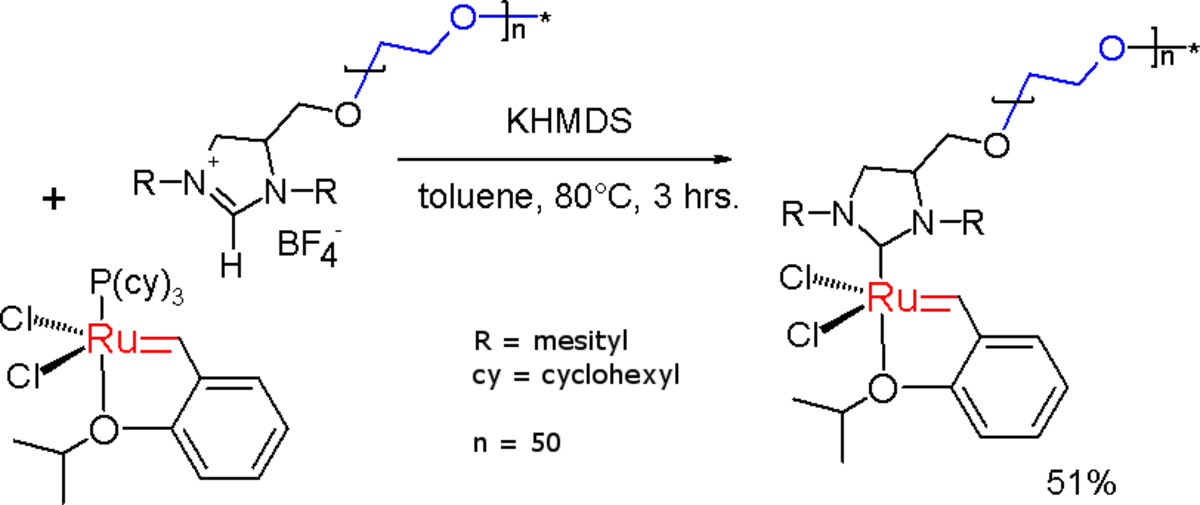
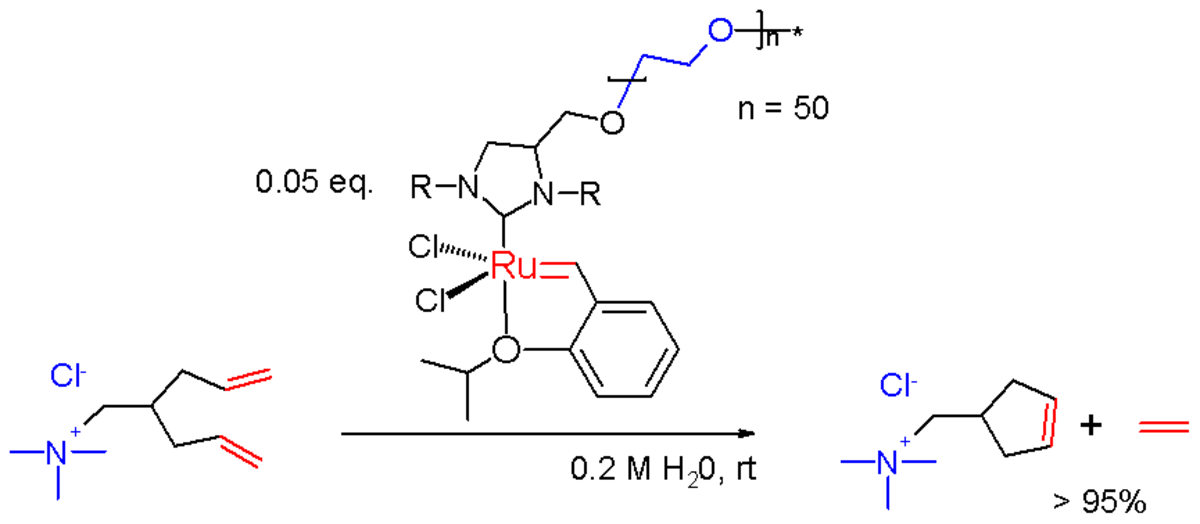
On peut préparer une version soluble dans l'eau du catalyseur de Grubbs, en attachant une chaine polyéthylene glycol au groupe imidazoline. Le sel d'imidazolinium est déprotoné avec du KHMDS (bis(triméthylsilyl)amidure de potassium) in situ pour former le NHC, qui se substitue à l'une des phosphines pour former un complexe de ruthénium modifié.
Ce catalyseur est utilisé dans la métathèse de fermeture de cycle dans l'eau de diènes portant des ammoniums les rendant solubles dans l'eau.
Deuxième génération
La seconde génération du catalyseur est employée dans les même domaines de synthèse que la première mais est beaucoup plus active. Contrairement à son prédécesseur, il est sensible à l'air et à l'eau, et doit donc être manipulé sous atmosphère d'argon ou d'azote. Un catalyseur basé sur un azote insaturé (1,3-bis(2,4,6-triméthylphényl)dihydroimidazole) a été décrit par l'équipe de Nolan en mars 1999. L'équipe de Grubbs a décrit un peu plus tard cette même année un catalyseur basé sur un carbène N-hétérocyclique saturé (1,3-bis(2,4,6-triméthylphényl)imidazolidine). L'un des ligands phosphine est remplacé par un carbène N-hétérocyclique (NHC)saturé, dans ce cas, le ruthénium est lié à deux carbènes. La dénomination IUPAC de la deuxième génération de ce catalyseur est benzylidène[1,3- bis(2,4,6-triméthylphényl)-2- imidazolidinylidène]dichloro(tricyclohexylphosphine)ruthénium. Les deux pemières générations de ce catalyseur sont commerciales.