Chlorure de soufre - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure de soufre | ||||
|---|---|---|---|---|
| ||||
| Général | ||||
| Nom IUPAC | ||||
| No CAS | ||||
| No EINECS | ||||
| Apparence | liquide fumant, huileux, ambre a rouge, d'odeur acre. | |||
| Propriétés chimiques | ||||
| Formule brute | S2Cl2 | |||
| Masse molaire | 135,036 ± 0,014 g·mol-1 | |||
| Propriétés physiques | ||||
| T° fusion | -77 °C | |||
| T° ébullition | 138 °C | |||
| Solubilité | dans l'eau : réaction | |||
| Masse volumique | 1,7 g·cm-3 | |||
| T° d’auto-inflammation | 234 °C | |||
| Point d’éclair | 118 °C (coupelle fermée) | |||
| Pression de vapeur saturante | à 20 °C : 0,90 kPa | |||
| Précautions | ||||
| | ||||
| ||||
| Phrases R : 14, 20, 25, 29, 35, 50, | ||||
| Phrases S : (1/2), 26, 36/37/39, 45, 61, | ||||
| | ||||
| ||||
| | ||||
|
1 3 1 | ||||
| | ||||


| ||||
| | ||||



Danger | ||||
| | ||||
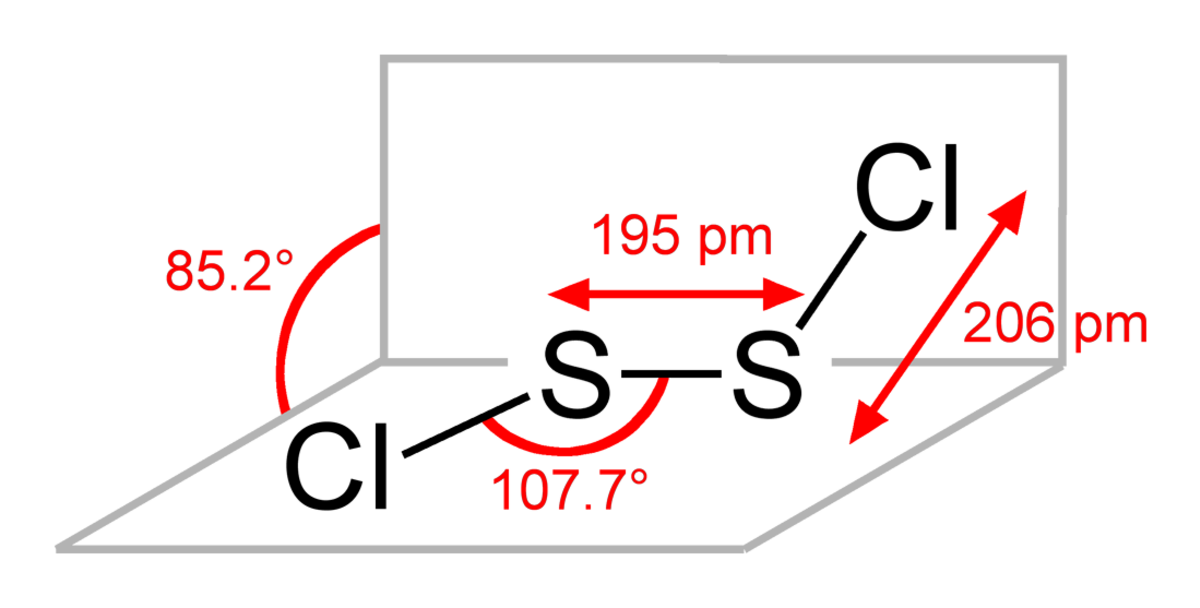
Le dichlorure de disoufre a pour formule S2Cl2. on l'appelle aussi (mono)chlorure de soufre , Nom impliqué par sa formule empirique SCl. S2Cl2 a une structure pliée dans laquelle l'angle entre les plan Cla-S-S et S-S-Clb est de environ 90 °. On dit que cette structure est gauche et elle est comparable à celle de H2O2. L'isomère de S2Cl2, S=SCl2, apparaît brièvement lors de l'exposition de S2Cl2 aux UV.
Synthèse
S2Cl2 se forme par chloration ménagée du soufre:
-
- S8 + 4 Cl2 → 4 S2Cl2 ΔH = -58.2 kJ/mol
- S2Cl2 + Cl2 → 2 SCl2 ΔH = -40.6 kJ/mol
Comme indiqué ci dessus, un excès de Cl2 convertit S2Cl2 en SCl2. Ces deux réactions sont réversibles. S2Cl2 est un sous produit de la chloration du disulfure de carbone dans la synthèse du thiophosgène.
Applications en synthèse
S2Cl2 a été utilisé pour introduire des liaisons C-S. En présence de chlorure d'aluminium, S2Cl2 réagit avec le benzène pour donner le disulfure de diphényle :
-
- S2Cl2 + C6H6 → (C6H5)2S + 2 HCl + 1/8 S8
Les Anilines réagissent avec S2Cl2 en présence de NaOH pour donner des ortho-aminothiophenolates suivant la réaction de herz, précurseur des colorants thioindigotiques. On s'en sert aussi pour préparer le gaz moutarde en le faisant réagir avec l'éthylène:
-
- S2Cl2 + 2 C2H4 → (ClC2H4)2S + 1/8 S8
Propriétés
Le chlorure de soufre est incolore à l'état pur mais les échantillons impurs sont souvent jaunes. Il se décompose en émettant de la fumée dans l'air humide à cause d'une réaction avec l'eau:
-
- 2 S2Cl2 + 2 H2O → SO2 + 4 HCl + 3/8 S8