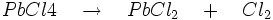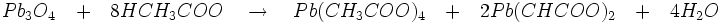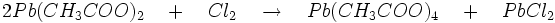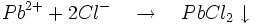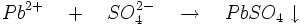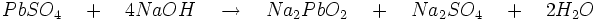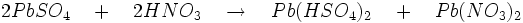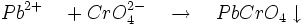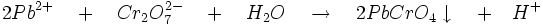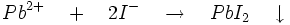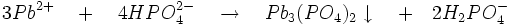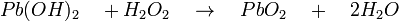Composés de l'ion plomb - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
Le cation Pb2+ fait partie du premier groupe de cations dans le schéma d'analyse qualitative.
Le système plomb-oxygène
- L'oxyde de Pb dérivé du Pb+2 a deux formes cristallines :
- une forme orthorhombique: la litharge jaune
- une forme quadratique rouge
- Le minium Pb3O4 dont la couleur peut varier avec le rapport
![n \quad =\quad \frac{[O]}{[Pb]}](https://static.techno-science.net/illustration/Definitions/autres/4/44017d028e1fe09cea581552911fb155_1228cf5ea88dd76dafea48ae6eb84c9e.png)
- Si n = 1,33, la teinte est orangée et nous avons Pb3O4, ou PbO22PbO.
- Lorsque n augmente, la couleur devient plus foncée jusqu'à la limite de n=1,54
Les composés du plomb IV
- Dérivés organoplombiques
- plomb tétraéthyle obtenu par l’action du chloroéthane sur l’alliage Pb-Na
-
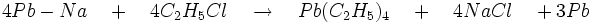
- Le plomb tétraméthyle
- Halogénure
- Le tétrachlorure de plomb PbCl4 est très instable et se décompose :
- Acétate : l’attaque de Pb3O4 par l’acide acétique suivie d’une oxydation par le chlore donne le tétra-acétate de plomb de couleur rouge selon les réactions:
-
Les composés du plomb II
- Les bases fortes forment avec le cation Pb2+ un précipité blanc d'hydroxyde de plomb ou acide plombeux qui est insoluble dans l'ammoniac :
-
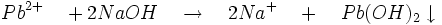
- L' acide plombeux réagit avec un excès d'hydroxyde de sodium pour former du plombite de sodium soluble.
-
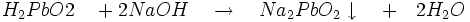
-
- Les chlorures précipitent le chlorure de plomb :
| Solubilité en g par 100 g d'eau | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Température | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| AgCl | - | 0,000088 | 0,00015 | - | - | 0,0005 | - | - | 0,002 |
| PbCl2 | 0,6728 | - | 0,99 | 1,2 | 1,45 | 1,7 | 1,98 | 2,62 | 3,34 |
- L'acide sulfurique précipite le cation Pb2+ en sulfate de plomb blanc:
- Les chromates et bichromates forment un chromate de plomb jaune très peu soluble dans l'eau, soluble dans les bases fortes, insoluble dans l'ammoniac et l'acide acétique.
-
- Les iodures forment avec le cation plomb le précipité jaune d'iodure de plomb
-
- Le peroxyde d'hydrogène oxyde l'hydroxyde de plomb en dioxyde de plomb PbO2 de couleur brune:
-
- Le sulfure PbS se forme sous l’action de H2S sur une solution de Pb2+