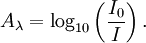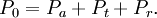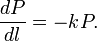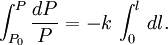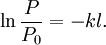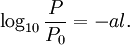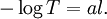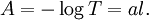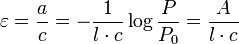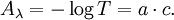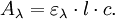Absorbance - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L'absorbance mesure la capacité d'un milieu à absorber la lumière qui le traverse. On l'appelle également densité optique ou extinction. Il s'agit d'une grandeur sans unité donnée par la relation :
L'absorbance est définie par le ratio entre l'intensité lumineuse I0, à une longueur d'onde λ, avant traversée du milieu, et l'intensité lumineuse transmise I exprimée en logarithme de base dix.
L'absorbance diffère selon la nature de l'élément et selon la longueur d'onde sous laquelle il est étudié.
Lois de l'absorption de la lumière
Soit un faisceau de lumière monochromatique qui traverse une couche de matière transparente (comme un morceau de glace par exemple). La plupart de l'énergie rayonnante passera à travers cette substance, mais une petite partie sera réfléchie ou absorbée. La somme totale de l'énergie incidente sera conservée, et exprimée par la relation :
P0 est l'énergie incidente, Pa est l'énergie absorbée, Pt est l'énergie transmise et Pr est l'énergie réfléchie. Si on peut compenser l'énergie perdue par la réflexion, moyennant une mise au point technique, on s'intéressera à la relation entre énergie incidente et énergie transmise. Cette relation a été formulée par Pierre Bouguer en 1729. La loi de Bouguer (connue aussi comme la loi de Lambert) consiste en deux parties; la première définit la transmittance, la seconde la variation de l'absorbance en fonction de l'épaisseur de la couche de substance traversée par la lumière.
Loi de Bouguer
Comme convenu précédemment, l'énergie transmise par un milieu homogène est proportionnelle à l'énergie appliquée sur celui-ci. Ainsi, l'énergie transmise par celui-ci sera toujours une partie de l'énergie totale appliquée. Ce rapport est défini comme la transmittance, T, qui s'exprime donc comme
Pour une substance donnée, avec une épaisseur et une longueur d'onde définies, T est une constante.
Comment varie la transmittance en fonction de l'épaisseur du milieu ?
Supposons qu'une substance, d'un 1 cm d'épaisseur permet à 50 % de l'énergie reçue de la traverser. Autrement dit, sa transmittance vaut 0,5. Si cette lumière obtenue passe par une deuxième couche de même épaisseur, une nouvelle fois seuls 50 % de celle-ci réussiront à passer à travers. Au passage successif par les deux couches, seulement 25 % de l'énergie de la lumière incidente ont été transmis par 2 cm de cette substance (0,5 x 0,5 = 0,52 = 0,25). De même, 3 cm transmettront 12,5 % du total reçu (0,5 x 0,5 x 0,5 = 0,53 = 0,125). Il s'agit donc là d'une progression géométrique : la transmittance ne diminue donc pas d'une manière linéaire quand l'épaisseur augmente, mais exponentielle (voir figure). En conséquence, le logarithme de T (logT) diminue linéairement en fonction de l'épaisseur.
Le changement subi par l'énergie rayonnante P en fonction de la longueur du trajet optique traversé l, est défini par la relation:
où k est une constante de proportionnalité. En intégrant cette équation, on obtient :
d'où :
Pour les chimistes, on remplace le logarithme népérien par le logarithme décimal en divisant le facteur k par 2,303 l'incorporant dans une nouvelle constante notée a (α pour les physiciens):
Comme
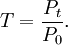
On définit maintenant l'absorbance par :
a est le coefficient d'absorption ou absorptivité du milieu exprimé en m-1 ou cm-1.
Dans une solution, on peut diviser le coefficient d'absorption par la concentration molaire des entités contenues dans le volume traversé par un faisceau lumineux :
ε, exprimée en L.mol-1.cm-1, est l'absorptivité molaire ou coefficient d'extinction molaire de l'entité en solution. Il dépend de la nature du corps absorbant, de la longueur d'onde choisie et de la température.
Loi de Beer-Lambert
Pour plus de détails, voir l'article Loi de Beer-Lambert
Utilisant le même raisonnement que celui de la loi de Bouguer, August Beer propose en 1852 une équation reliant l'absorbance et la transmittance à la concentration d'une substance en solution. La loi est énoncée de la manière suivante :
La concentration c est exprimée en mol.L-1 ou en mol.m-3. L'absorptivité a peut être substituée dans l'équation par le coefficient d'extinction molaire ε comme défini précédemment. Alors, par la combinaison des deux équations, on obtient la loi de Beer-Bouguer mieux connue comme la loi de Beer-Lambert :
La mesure de l'absorbance se fait grâce à un spectrophotomètre. l est la longueur du chemin optique traversé par la lumière dans la solution en cm. En pratique, cette longueur correspond à l'épaisseur de la cuve de mesure (généralement prise de 1cm).
Cette loi permet aux chimistes de déterminer la concentration inconnue d'un ou plusieurs éléments dans une solution donnée. Toutefois, cette proportionnalité entre la concentration et l'absorbance ne serait plus applicable pour c > 0,01 mol.L-1 (car le phénomène de réflexion n'est plus négligeable).