Fluorure de césium - Définition
La liste des auteurs de cet article est disponible ici.
Précautions
Comme les autres fluorures solubles, CsF possède une toxicité modérée. Il ne doit pas être mis en contact avec des acides pour éviter la formation d'acide fluorhydrique. Les ions césium Cs+ ne sont généralement pas considérés comme toxiques.
Utilisation
Le fluorure de césium est une base utile en chimie organique, du fait de la faible nucléophilie des ions fluorures. Il permet d'obtenir de meilleurs rendements que le fluorure de potassium ou le fluorure de sodium au cours d'une condensation de Knoevenagel.
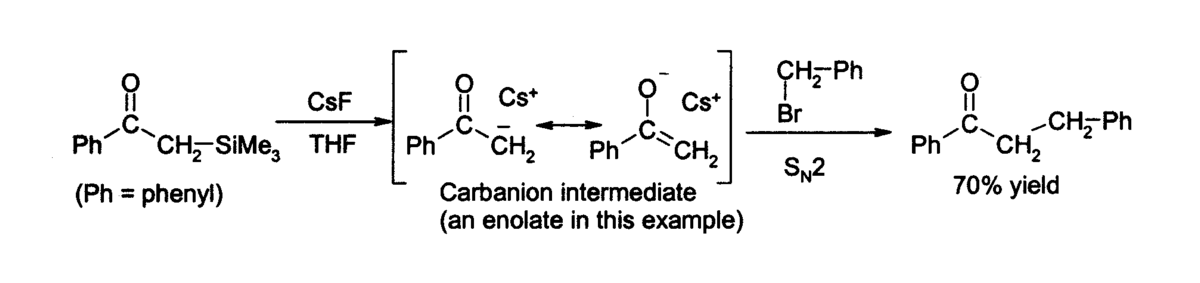
Une des applications principales du fluorure de césium en laboratoire est la désilylation, sa forme anhydre permettant la formation d'intermédiaires sensibles à l'eau. Dans le THF ou le DMS, il peut attaquer une grande variété de composés organosiliciés en produisant un fluorure et un carbanion, qui peut ensuite réagir avec un électrophile, comme par exemple:
Il permet également d'éliminer des groupements protecteurs silyls.
CsF est également une source populaire d'ions fluorures en chimie des organofluorés. Par exemple, il réagit avec l'hexafluoroacétone pour former un sel de perfluoroalkoxide de césium stable jusqu'à 60°c, contrairement au sel de sodium ou de potassium correspondant.
Sous forme monocristalline, il est transparent dans le domaine des infrarouges lointains. De ce fait, il est souvent utilisé pour les fenêtres des cellules de spectroscopie infrarouge.