Insertion cotraductionnelle des protéines membranaires - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L'insertion cotraductionnelle des protéines membranaires permet l'insertion d'une protéine dans une membrane au cours de sa traduction. Ce processus permet uniquement à la formation de protéines à hélices α transmembranaires. L'insertion membranaire des protéines monotopiques ou des protéines à tonneau β transmembranaire se fait par des mécanismes post-traductionnels, de même que pour certaines protéines à hélices α transmembranaires.
Insertion cotraductionnelle des protéines membranaires de type I
Étape 1
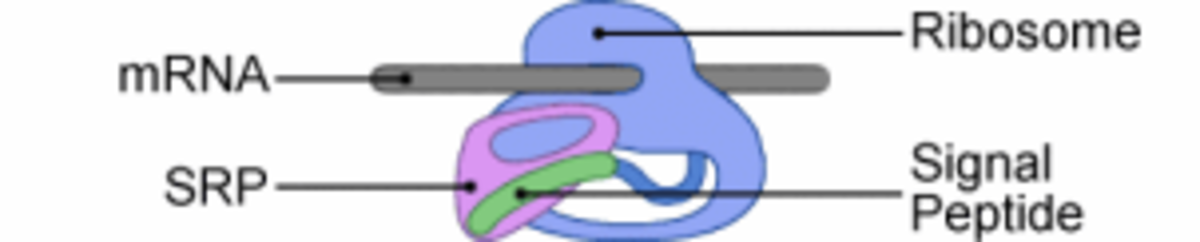
L'insertion cotraductionnelle se déroule à proximité de la membrane du Réticulum Endoplasmique (RE) chez les eucaryotes (de la membrane plasmique chez les procaryotes). La traduction des protéines membranaires de type I commence dans le cytosol par une séquence N-terminale particulière appelée Peptide Signal (PS). Le PS est reconnu par SRP (Signal Recognition Particule) dès sa sortie du ribosome. SRP se fixe au PS et au ribosome ralentissant, voire stoppant, la traduction.
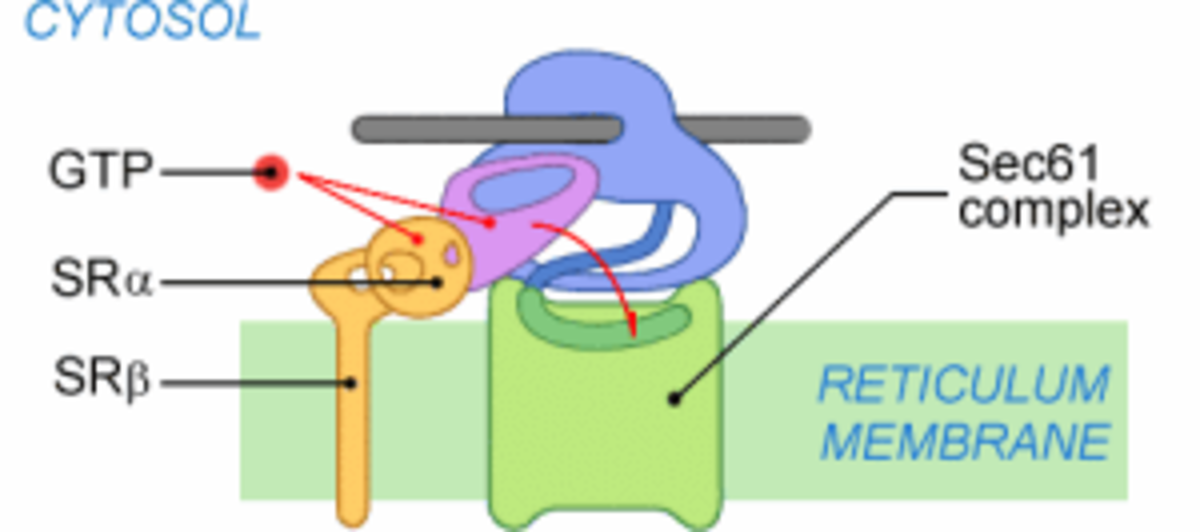
Étape 2
Une fois le PS reconnu, la protéine est adressée à la membrane. Chez les mammifères, SRP est reconnue par SR (SRP Receptor), un récepteur membranaire du réticulum. L'interaction SRP-SR est régulée par le GTP. La fixation de GTP sur SRP54 permet la dissociation de SRP et du PS. La fixation d'un GTP sur la sous-unité SRα stabilise l'ancrage SRP-SR. La déstabilisation du complexe SRP-PS est compensée par l'ancrage du ribosome au complexe de translocation, ou translocon.
Étape 3
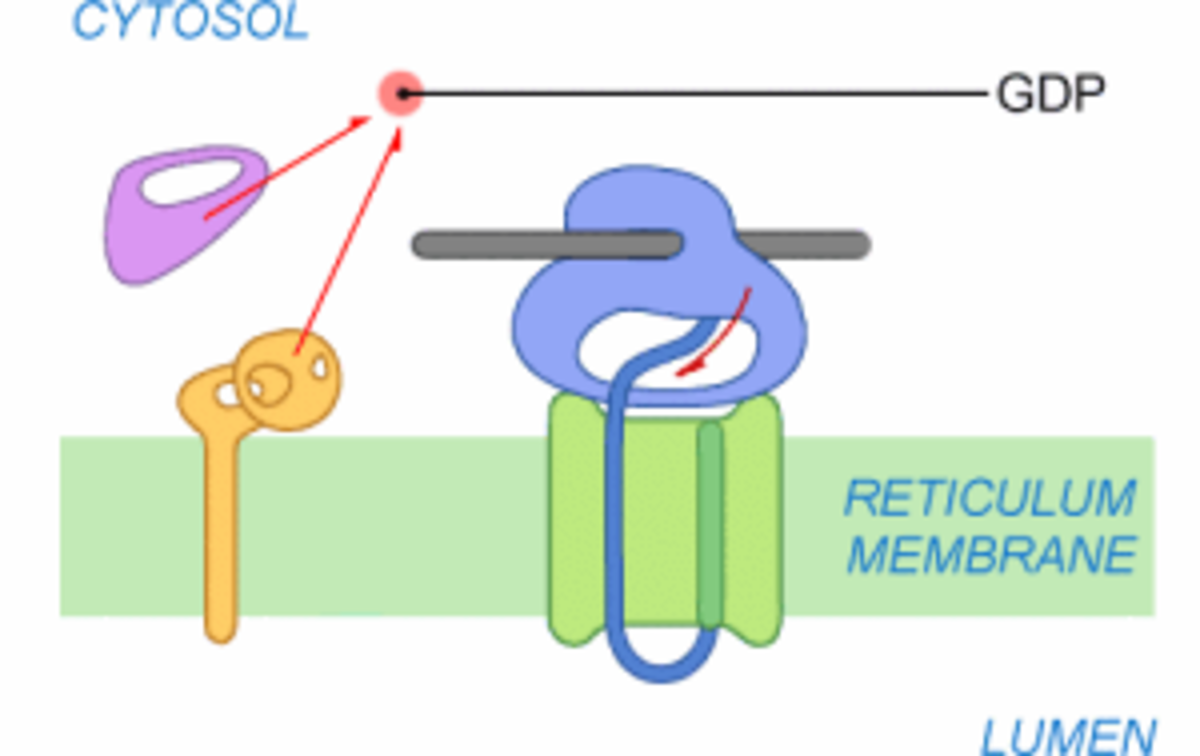
Le transfert à travers la membrane du RE commence. Dans un premier temps, le peptide signal est reconnu par le translocon et commence à pénétrer dans le canal. Le complexe SRP-SR se dissocie du ribosome. SRP se dissocie de SR après hydrolyse du GTP en GDP et devient à nouveau opérationnel. Le ribosome n’est plus bloqué et reprend la traduction de l'ARNm. Le peptide en cours de synthèse se retrouve directement orienté vers le canal du translocon.
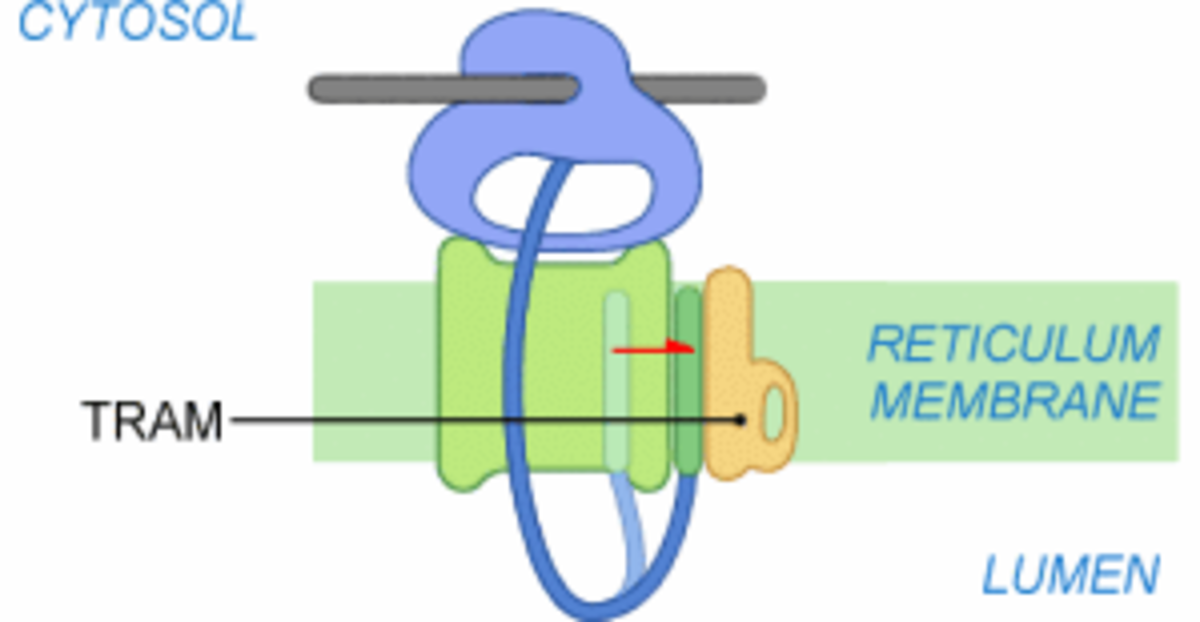
Étape 4
À ce stade, le ribosome est fortement lié au translocon. Le peptide signal se retrouve en contact avec le translocon et TRAM (Translocating Chain Associating Membrane protein), une glycoprotéine satellite du complexe de translocation. TRAM n'est pas systématiquement requise lors de la translocation. Elle semble tout de même souvent nécessaire à l'insertion des protéines membranaires. Le contact entre le PS et TRAM est possible grâce à une ouverture du canal formé par Sec61 sur la périphérie du translocon.
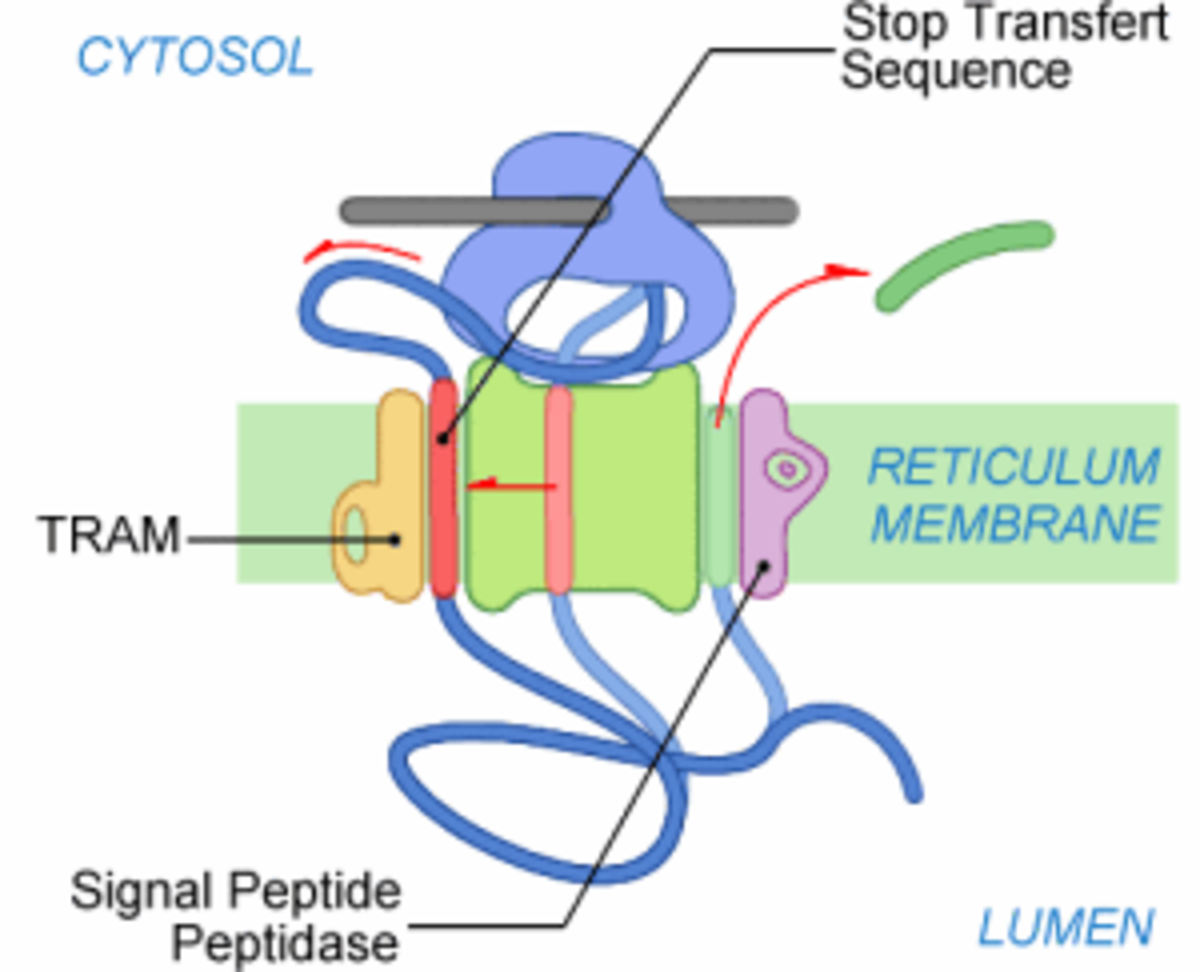
Étape 5
La synthèse du polypeptide continue. Il est transféré à travers la membrane au fur et à mesure de son élongation jusqu'à la synthèse d'une séquence hydrophobe particulière qui bloque le transfert du polypeptide. Cette séquence est appelée Signal d'Arrêt de Transfert (SAT). Le SAT est composé d'une vingtaine de résidus hydrophobes. Grâce à son hydrophobie il suit le même chemin que le peptide signal et se retrouve en périphérie du complexe de translocation, probablement en contact avec TRAM. Cette translation est possible grâce à une ouverture latérale du translocon.
Dans un même temps, le PS est clivé dès que le site de clivage est accessible à la Signal Peptidase (SPase). Le site de clivage est situé en C-terminal du PS. Le PS clivé est ensuite dégradé. On retrouve ses reliquats dans le cytosol. Pendant ce temps, la traduction continue. Le ribosome est toujours lié au translocon, mais la partie C-terminale en cours de synthèse n'est plus transférée à travers le translocon.
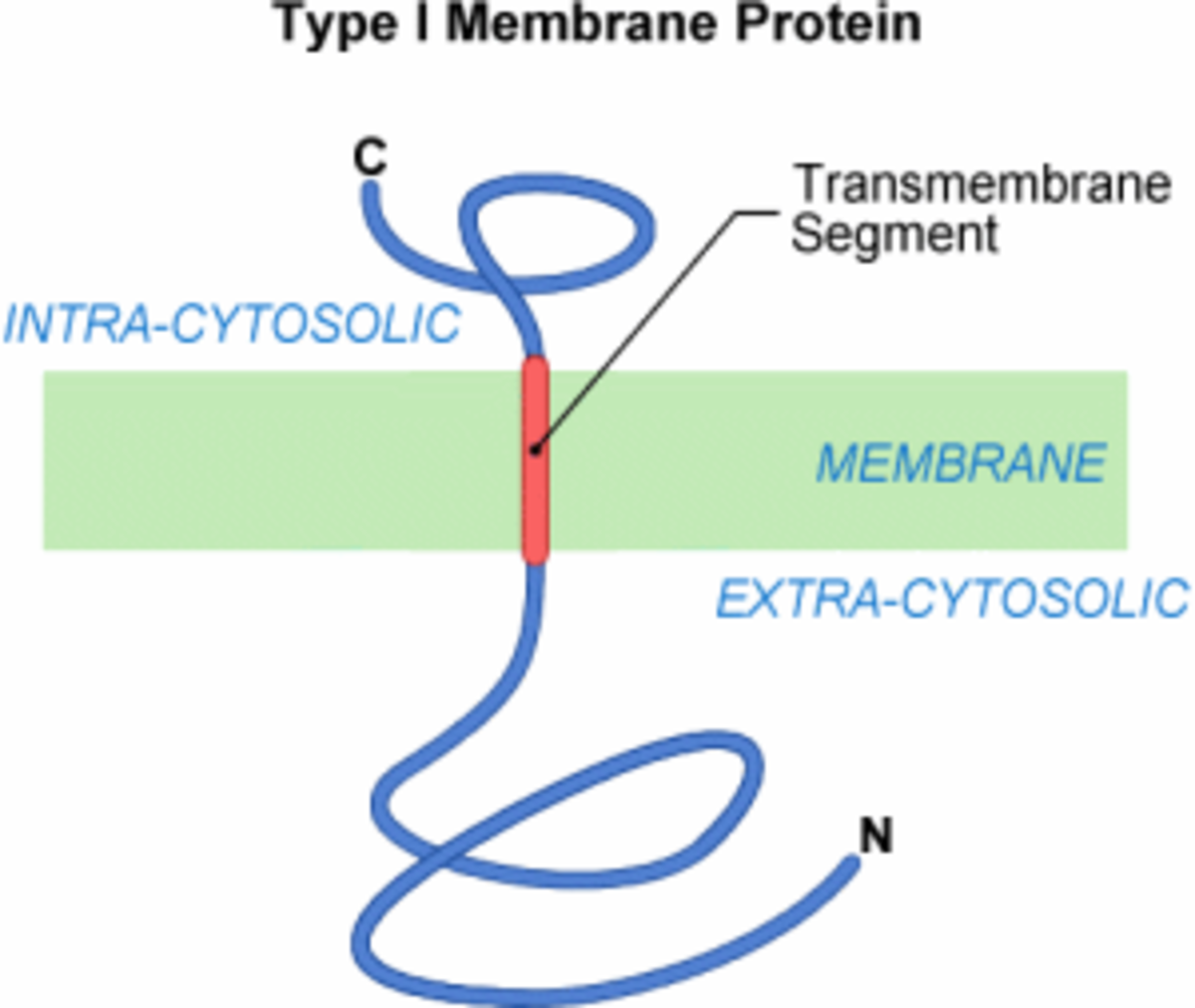
Étape 6
La traduction de la protéine membranaire de type I est achevée. La protéine a directement été insérée avec la bonne topologie membranaire, c’est-à-dire avec une partie N-terminal extra-cytosolique et une partie C-terminale intracytosolique. Cette insertion a emprunté la voie d'exportation des protéines sécrétées dans le milieu extérieur. Elle a nécessité en plus une séquence hydrophobe, la SAT, permettant l'insertion de la protéine dans le milieu membranaire. La SAT constitue donc l'ancrage membranaire de la protéine. L'insertion cotraductionnelle peut finalement être considérée comme un transfert partiel. Mais il faut savoir que le translocon possède d'autres capacités. Il peut, par exemple, fonctionner dans le sens inverse et renvoyer des protéines en cours de transfert vers le cytosol. On parle alors de retrotranslocation. La translocation cotraductionnelle est donc un mécanisme très souple et sans doute très finement régulé par la cellule.