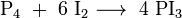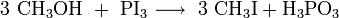Iodométhane - Définition
La liste des auteurs de cet article est disponible ici.
Choix de l'iodomethane comme agent de méthylation
L'iodomethane est un excellent agent de méthylation, mais il y comporte certains inconvénients. Comparé à d'autres halogénométhanes (chlorométhane en particulier) son poids équivalent est plus élevé: une mole de MeI pèse près de trois fois plus que une mole de MeCl. Toutefois, le chlorométhane est un gaz (comme le bromurométhane), ce qui rend leur utilisation plus délicate que l'iodométhane qui est un liquide. Le chlorométhane est un agent de méthylation bien moins fort que MeI, mais il suffit dans la plupart des réactions.
Les iodures sont généralement bien plus coûteux que leurs équivalents chlorures ou bromures, mais ce n'est pas le cas de l'iodomethane dont le prix est abordable. À l'échelle commerciale, le sulfate de diméthyle, bien que toxique, est préféré, car il est à la fois bon marché et liquide.
Lors des réactions de substitutions nucléophiles le départ du groupe partant, I- peut entrainer des réaction parasites, car c'est un puissante nucléophile. Enfin, de par sa forte réactivité MeI est plus dangereux pour les personnels le manipulant que ses équivalents bromés et chlorés.
Production et synthèse
L'iodométhane peut être synthétisé par une réaction exothermique, par réaction de diiode avec le méthanol en présence de phosphore. Le diidode est alors transformé in situ en triiodure de phosphore. Il s'en suit une substitution nucléophile avec le méthanol:
Une autre méthode est de faire réagir le sulfate de diméthyle avec l'iodure de potassium en présence de carbonate de calcium :
L'iodométhane peut ensuite être obtenu par distillation après lavage au thiosulfate de sodium afin d'éliminer l'excès d'iode.
L'iodométhane peut aussi être produit lors d'accidents nucléaires, par réaction de composés organiques avec de « l'iode de fusion ».
Toxicité et effets biologiques
L'Iodomethane a une LD50 (oral) pour les rats de 76 mg·kg-1, et dans le foie, il est rapidement converti en S-méthylglutathion. L'iodomethane est potentiellement carcérigèneselon les classifcation du CIRC de l'ACGIH, du NTP, et de l'APE. Le CIRC le classe dans le groupe 3 (inclassables quant à leur cancérogénicité pour l'Homme).
L'inhalation de vapeurs d'iodomethane peut provoquer des dommages aux poumons, au foie, aux reins et au système nerveux. Il provoque nausées, étourdissements, toux et vomissements. Un contact prolongé avec la peau provoque des brûlures. Une inhalation massive peut provoquer un œdème pulmonaire.