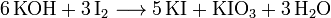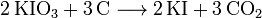Iodure de potassium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Iodure de potassium | |
|---|---|


| |
| Général | |
| No CAS | |
| No EINECS | |
| Code ATC | R05 S01 V03 |
| SMILES | |
| InChI | |
| Apparence | Solide blanc cristallin |
| Propriétés chimiques | |
| Formule brute | KI |
| Masse molaire | 166,0028 ± 0,0001 g·mol-1 |
| Moment dipolaire | ≈10,8 D |
| Propriétés physiques | |
| T° fusion | 686 °C |
| T° ébullition | 1 330 °C |
| Solubilité | 1 430 g·l-1 (eau, 20 °C) |
| Masse volumique | 3,13 g·cm-3 à 20 °C |
| Cristallographie | |
| Réseau de Bravais | cubique |
| Précautions | |
| | |

| |
| Composés apparentés | |
| Cations apparentés | Iodure de lithium Iodure de sodium Iodure de rubidium Iodure de césium |
| Anions apparentés | Fluorure de potassium Chlorure de potassium Bromure de potassium |
| | |
L'iodure de potassium est un composé inorganique de formule KI. C'est un sel blanc. Il est moins hygroscopique que l'iodure de sodium, ce qui rend sa manipulation plus facile. Les vieux échantillons impurs présentent une teinte jaune due à l'oxydation de l'iodure en diiode.
Structure
L'iodure de potassium est un cristal ionique, K+;I-, de même structure que le chlorure de sodium, c'est-à-dire deux réseaux cubiques à faces centrées imbriqués l'un dans l'autre, décalés de a/2 suivant l'un des axes de la maille.
Utilisation pharmaceutique
L'iodure de potassium est utilisé en cas de contamination radioactive. L'administration préventive permet de saturer la thyroïde en iode non radioactive afin d'empêcher l'iode radioactive de s'y déposer et d'entrainer un cancer.
Production
L'iodure de potassium est produit par la réaction l'hydroxyde de potassium avec du diiode :
L'iodate de potassium (KIO3) est ensuite réduit par du carbone :