Iodométhane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Iodométhane | |||
|---|---|---|---|

| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Iodure de méthyle | ||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique. devient brun lors d'exposition à la lumiere et l'humidite. | ||
| Propriétés chimiques | |||
| Formule brute | CH3I | ||
| Masse molaire | 141,939 ± 0,001 g·mol-1 | ||
| Moment dipolaire | 1,59 D | ||
| Propriétés physiques | |||
| T° fusion | -66,5 °C | ||
| T° ébullition | 42,5 °C | ||
| Solubilité | dans l'eau à 20 °C : 14 g·l-1 | ||
| Masse volumique | 2,3 g·cm-3 | ||
| T° d’auto-inflammation | 352 °C | ||
| Limites d’explosivité dans l’air | 8.5 - 66% | ||
| Pression de vapeur saturante | à 20 °C : 50 kPa, 24.09 psi à 55 °C | ||
| Point critique | 65,9 bar, 254,85 °C | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,538 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,5304 (20 °C, D) 1,5293 (21 °C, D) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 21, 23/25, 37/38, 40, | |||
| Phrases S : (1/2), 36/37, 38, 45, | |||
| | |||
| |||
| | |||
| Produit non classifié | |||
| | |||

Danger | |||
| | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||
| Écotoxicologie | |||
| LogP | 1,51-1,69 | ||
| | |||
L'iodométhane, aussi appelé iodure de méthyle, est un composé chimique de formule CH3I, parfois noté MeI. Il s'agit d'un halogénoalcane, dérivé du méthane, où l'un des atomes d'hydrogène a été substitué par un atome d'iode. Il se présente sous la forme d'un liquide incolore, dense, volatile, à l'odeur éthérée, et qui prend un teint violacé exposé à la lumière, dû à la présence de diiode I2. L'iodométhane est couramment utilisée en synthèse organique en tant que donneur de groupe méthyle, dans des réactions appelées méthylations. Il est naturellement émis en faible quantité par le riz.
L'iodométhane s'hydrolyse à 270 °C, formant de l'iodure d'hydrogène, de monoxyde de carbone et du dioxyde de carbone.
Utilisations
Réactions de méthylation
L'iodométhane sert essentiellement pour la méthylation d'autre composés, par des réactions de type SN2. Il peut stériquement facilement être attaqué par des nucléophiles, et l'iodure est un bon nucléofuge.
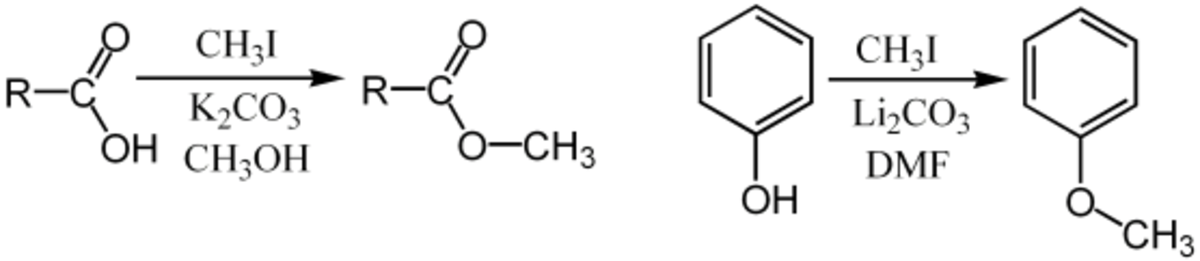
Il peut par exemple être utilisé pour la méthylation d'acides carboxyliques (transformation en méthanoate de carboxyle) ou de phénols (formation de méthoxybenzènes):
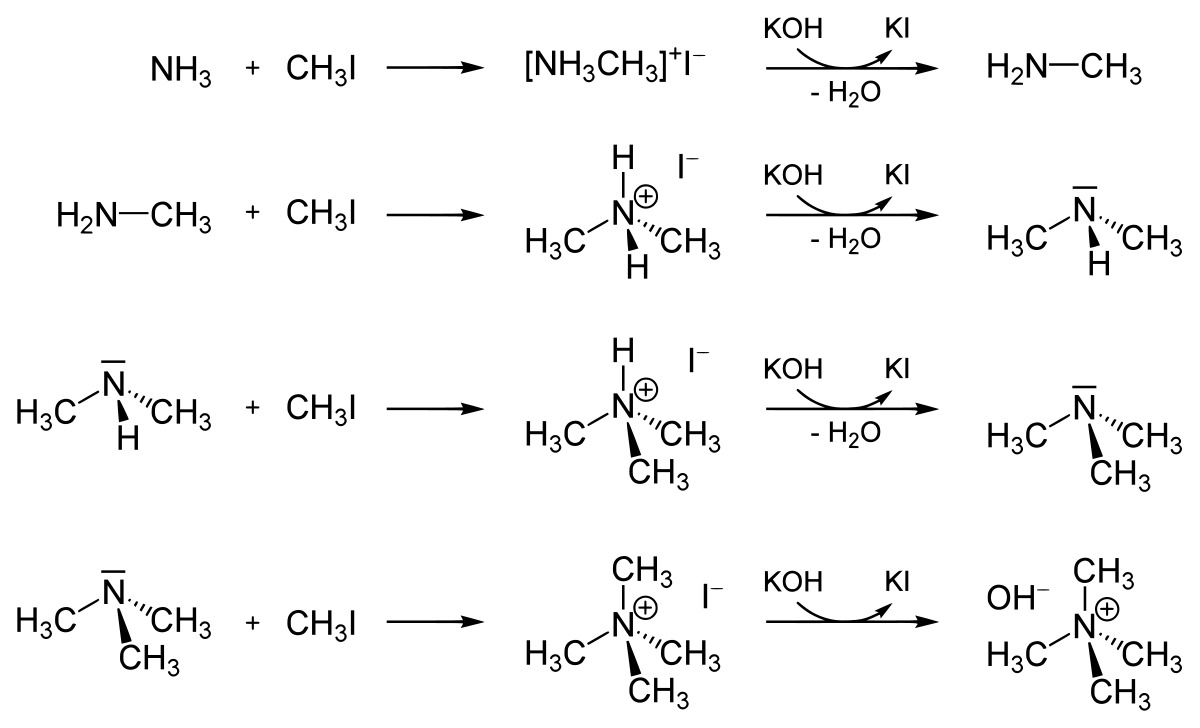
Il peut aussi servir à la méhylation de l'ammoniac et des amines dérivés en iodoammonium. Cette réaction peu se poursuivre, jusqu'à la formation d'un hydroxyde de tétraméthylammonium.
L'iodométhane est aussi un précurseur de l'iodure de méthylmagnesium ou « MeMgI », un organomagnésien souvent utilisé comme réactif. MeMgI se forme assez facilement, il est donc assez souvent utilisé en tant qu'exemple dans l'enseignement de préparation d'organomagnésiens. L'utilisation de MeMgI a cependant été supplantée par l'utilisation de méthyllithium.
Dans le procédé Monsanto , MeI est formé in situ par la réaction du méthanol et de l'iodure d'hydrogène. Il réagit ensuite avec le monoxyde de carbone en présence de rhodium pour former de l'iodure d'éthanoyle, précurseur de l'acide acétique (obtenu par hydrolyse). Une grande partie de l'acide acétique produit dans le monde l'est par cette méthode.
Autres
Outre son utilisation comme agent de méthylation, certains proposent d'utiliser l'iodométhane comme fongicide, herbicide, insecticide, nématicide ou même dans les extincteurs. Il peut être utilisé comme désinfectant des sols, replaçant le bromométhane (dont l'utilisation a été bannie par la protocole de Montréal), et en microscopie pour ses propriétés liées à son indice de réfraction.