Oxyde de calcium - Définition
La liste des auteurs de cet article est disponible ici.
| Oxyde de calcium | |||
|---|---|---|---|
| |||
| Général | |||
| No CAS | |||
| No EINECS | |||
| No E | E529 | ||
| Apparence | poudre cristalline, hygroscopique, blanche. | ||
| Propriétés chimiques | |||
| Formule brute | CaO | ||
| Masse molaire | 56,077 ± 0,004 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 2 570 °C | ||
| T° ébullition | 2 850 °C | ||
| Solubilité | 1,65 g·l-1 eau à 20 °C Réagit violemment avec l'eau | ||
| Masse volumique | 3,3–3,4 g·cm-3 | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 6,66 ± 0,18 eV (gaz) | ||
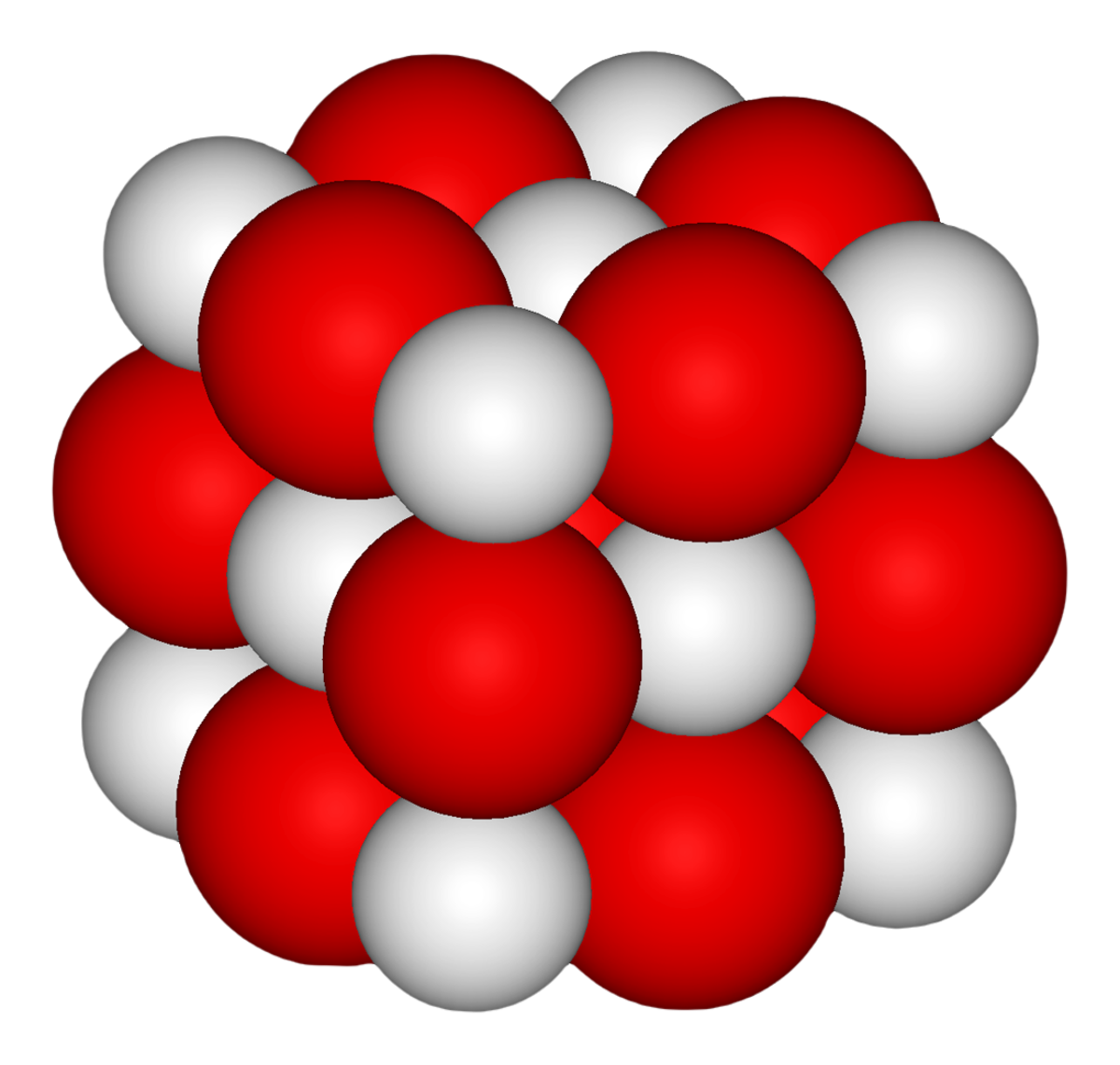
| Cristallographie | |||
| Système cristallin | cubique | ||
| symbole de Pearson | cF8 | ||
| Classe cristalline ou groupe d’espace | Fm3m (n°225) | ||
| Strukturbericht | B1 | ||
| Structure type | NaCl | ||
| Paramètres de maille | a = 4,8108 Å | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 34, | |||
| Phrases S : 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
0 3 1 | |||
| | |||

| |||
| | |||
L'oxyde de calcium, communément appelé chaux vive, est un produit obtenu par calcination du calcaire à 825 °C.
On dit que CaO est de la chaux vive car elle réagit violemment avec l'eau, en produisant de la chaleur, selon la réaction CaO + HO -> Ca(OH). C'est la chaux éteinte (elle ne réagit plus avec l'eau). La chaux est un enduit de choix, car, par carbonatation à l'air libre (grâce au CO atmosphérique) :
Ca(OH) + CO -> CaCO + HO, elle devient du carbonate de calcium (CaCO3), ou calcaire, retrouvant sa solidité initiale. Ainsi, la chaux dite "éteinte" enduite sur les murs, crée une couche de calcaire (généralement colorée rouge, orange ou encore jaune). La chaux vive est irritante pour la peau, car elle réagit avec l'eau présente sur la peau et produit de la chaux éteinte, qui est très basique (pKa = 12,6 pour le couple Ca + 2 HO/Ca(OH)).