Peroxyde d'acétone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Peroxyde d'acétone | ||
|---|---|---|

| ||
| Général | ||
| Nom IUPAC | ||
| No CAS | ||
| No E | E929 | |
| Apparence | poudre blanche, cristaux monocliniques, odeur âcre | |
| Propriétés chimiques | ||
| Formule brute | dimère : C6H12O4 148,157328 g∙mol-1 trimère : C9H18O6 222,235992 g∙mol-1 tétramère : C12H24O8 296,314656 g∙mol-1 | |
| Propriétés physiques | ||
| T° fusion | 91 °C | |
| T° ébullition | 130 °C | |
| Solubilité | Insoluble dans l'eau; Peu soluble dans l'éthanol, l'isopropanol, la glycérine, l'acide acétique glacial; Soluble dans l'acétone, l'éther, l'acétate d'éthyle, l'hexane, le benzène | |
| Masse volumique | 1,18 | |
| Précautions | ||
| | ||
| ||
| | ||

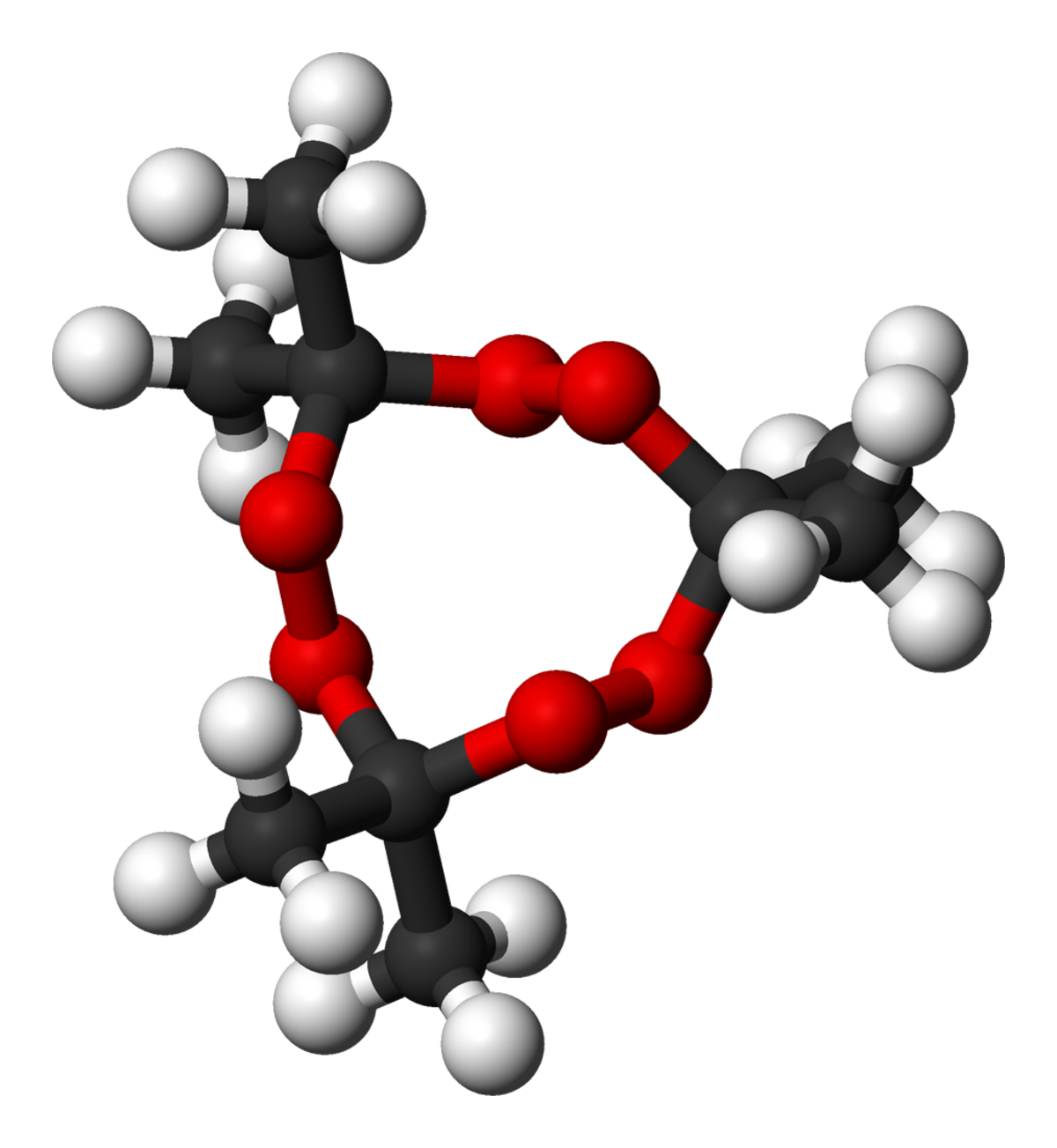
Le peroxyde d'acétone est un explosif primaire découvert en 1895 par R. Wolffenstein. C'est une famille de molécules instables constituées de peroxydes organiques cycliques. On le rencontre le plus souvent sous la forme d'une poudre blanche cristalline. Il a une odeur âcre caractéristique.
Chimie
De fabrication simple, il peut être obtenu à partir d’eau oxygénée (peroxyde d'hydrogène) et d’acétone (propanone). L’acide chlorhydrique, l'acide sulfurique (acides forts) ou encore le chlorure d'étain(IV) servent à catalyser la réaction qui doit se faire à froid. L'obtention du précipité (des cristaux blancs) se fait par une réaction fortement exothermique. Les molécules contiennent dans leur cycle des liaisons peroxydes, ce qui explique l'instabilité du produit.
Expérimentalement, si l'on essaie de produire la réaction à chaud, le peroxyde d'acétone et le peroxyde d'hydrogène se vaporisent et se dégagent lentement sous forme d'une fumée blanche, épaisse et âcre, plus lourde que l'air ambiant, qui détone très violemment au contact d'une source de chaleur incandescente (étincelle, filament d'ampoule électrique,...), ce qui est excessivement dangereux et totalement incontrôlable.
La réaction est quasiment complète, mais la réaction produisant beaucoup de chaleur peut vaporiser le peroxyde d'hydrogène ou l'acide fort utilisé comme catalyseur, ce qui peut provoquer des brûlures irréversibles aux mains et aux yeux.
D'ailleurs, si le mélange est "noyé" dans l'acétone, les flocons de peroxyde d'acétone se dissolvent et le mélange se met spontanément à bouillir, jusqu'à disparition complète du peroxyde. À cette occasion, le récipient contenant le mélange peut se fêler ou se briser net sous l'effet de la chaleur intense.
Le catalyseur employé lors de la fabrication détermine la proportion des molécules produites. Le peroxyde d'acétone existe sous plusieurs formes oligomères cycliques dont les formules chimiques sont:
- C6H12O4 (diperoxyde d'acétone)
- C9H18O6 (triperoxyde d'acétone)
- C12H24O8 (tetraperoxyde d'acétone)
Le produit connu sous le nom de péroxyde d'acétone contient majoritairement la forme trimère cyclique, le triperoxyde de tricycloacétone (en anglais TATP:triacetone triperoxide ou TCAP: tricyclicacetonperoxide ). Cette molécule est métastable et se décompose lentement en diperoxyde d'acétone qui est moins stable vis à vis de sa décomposition explosive que la forme trimère. Cette baisse de stabilité est en partie explicable par des contraintes structurales accrues chez la forme dimère par rapport au trimère, notamment en ce qui concerne les angles de liaisons des atomes d'oxygène inclus dans le cycle des molécules. C'est une raison supplémentaire pour éviter de stocker ce produit pendant une longue durée.