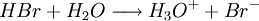Acide bromhydrique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
- Cet article concerne le bromure d'hydrogène en solution. Pour des informations concernant le gaz bromure d'hydrogène, voir l'article bromure d'hydrogène.
| Acide bromhydrique | ||
|---|---|---|
| Général | ||
| Nom IUPAC | ||
| No CAS | ||
| No EINECS | ||
| PubChem | ||
| SMILES | ||
| InChI | ||
| Apparence | Liquide incolore | |
| Propriétés chimiques | ||
| Formule brute | HBr H3O+ + Br- | |
| Masse molaire | 80,912 ± 0,001 g·mol-1 | |
| pKa | -8 | |
| Précautions | ||
| | ||
| ||
| Phrases R : 34, 37, | ||
| Phrases S : 1/2, 7/9, 26, 45, | ||
| | ||
|
0 3 0 | ||
| Écotoxicologie | ||
| DL | 76 mg·g-1 (rat, intrapéritonéale) | |
| | ||
L’acide bromhydrique est une solution aqueuse contenant des ions bromures et des ions hydroniums. L'acide bromhydrique est formé par dissolution de bromure d'hydrogène HBr dans de l'eau et peut donc être utilisée pour préparer des sels de brome : les bromures.
Acidité
L'acide bromhydrique est un acide fort, plus fort que l'acide chlorhydrique mais plus faible que l'acide iodhydrique ainsi que l'acide perchlorique. Il est totalement dissocié dans l'eau. La molécule HBr se dissocie (s'ionise) pour donner un ion H+ (un proton). L'autre ion formé lors de la dissociation est l'ion bromure Br-. En solution aqueuse, l'ion H+ se lie à une molécule d'eau pour former un ion hydronium H3O+.
Le pKa du couple HBr (aq)/Br- vaut -8.
Réactivité
L'acide bromhydrique, sous l'action d'un grand nombre d'oxydants est transformé en dibrome et en eau. L'ion bromure est un réducteur et participe à des réactions d'oxydo-réduction. L'attaque du zinc dans une solution d'acide bromhydrique est plus rapide que celle du plomb, du cuivre et de l'argent.