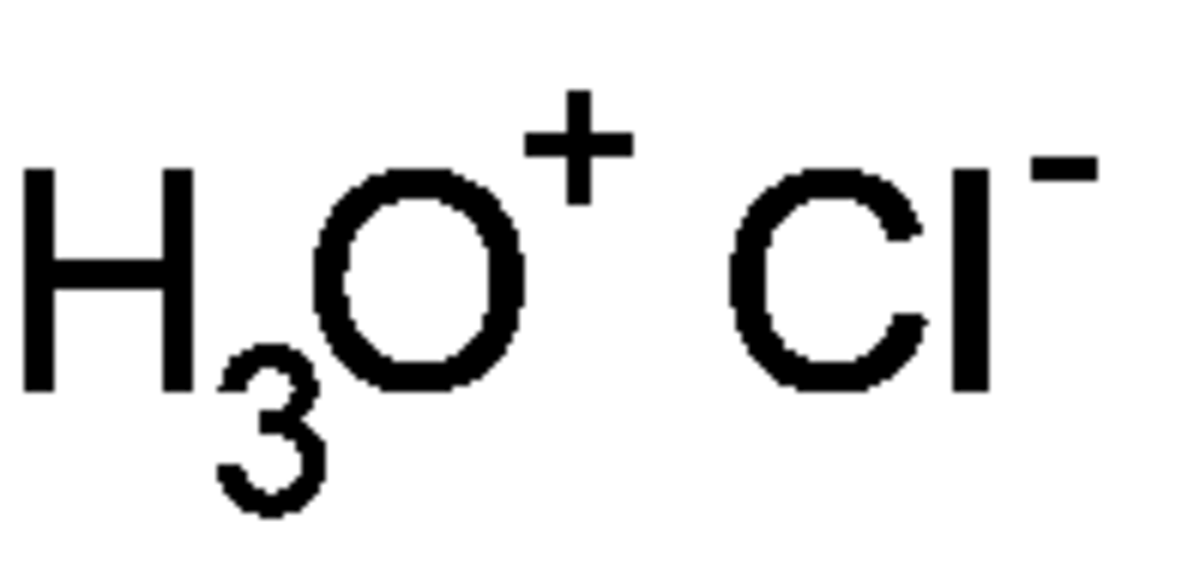Acide chlorhydrique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide chlorhydrique | |||
|---|---|---|---|
|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | solution de chlorure d'hydrogène | ||
| No CAS | |||
| No EINECS | |||
| No E | E507 | ||
| Apparence | Liquide incolore | ||
| Propriétés chimiques | |||
| Formule brute | HCl | ||
| Masse molaire | 36,461 ± 0,002 g·mol-1 | ||
| pKa | acide fort dans l'eau | ||
| Propriétés physiques | |||
| T° fusion | -30 °C, 37 % HCl | ||
| T° ébullition | 48 °C, 38 % HCl | ||
| Solubilité | 700 g·l-1 (eau) | ||
| Masse volumique | 1,19 g·cm-3 (solution à 37%) | ||
| T° d’auto-inflammation | N/A | ||
| Viscosité dynamique | 1,53 mPa·s à 25 °C | ||
| Thermochimie | |||
| S0 | 186,9 kJ·K-1·mol-1 | ||
| ΔH0 | -92,31 kJ·mol-1 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 34, 37, | |||
| Phrases S : 26, 36, 45, | |||
| | |||
| |||
| | |||
|
0 3 1 | |||
| | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||
| Inhalation | Les vapeurs peuvent être mortelles | ||
| Peau | Peut provoquer de graves blessures | ||
| Yeux | Très dangereux | ||
| Ingestion | Toxique, parfois mortelle | ||
| | |||
L'acide chlorhydrique est une solution aqueuse ayant pour solutés des ions oxonium H3O+ et des ions chlorure Cl-. On peut l'obtenir par dissolution de chlorure d'hydrogène HCl qui est un gaz. Ce dernier est un acide fort qui s'ionise totalement en solution aqueuse. L'acide chlorhydrique est le principal constituant des acides gastriques. C'est un acide couramment utilisé comme réactif dans l'industrie chimique. L'acide chlorhydrique étant un liquide très corrosif, il doit être manié avec précaution. L'acide chlorhydrique concentré peut avoir un pH inférieur à 1.
L'acide chlorhydrique, connu également dans l'histoire sous le nom d'acide muriatique (ce nom est antérieur à la découverte du chlore et de la formule chimique HCl) a été découvert par l'alchimiste Jabir Ibn Hayyan au voisinage de l'an 800. C'est une espèce chimique qui a été fréquemment utilisée dans l'histoire depuis les débuts de la chimie. Au Moyen Âge, il était utilisé par les alchimistes dans leur quête de la pierre philosophale (sous le nom d'« esprit de sel » ou acidum salis). Il fut ensuite utilisé par de nombreux scientifiques, parmi lesquels Glauber, Priestley ou Davy, qui contribuèrent à établir la chimie moderne.
Au cours de la révolution industrielle, l'acide chlorhydrique devint un réactif chimique industriel important utilisé dans de nombreuses applications, notamment pour la production à grande échelle de composés organiques comme le chlorure de vinyle pour le PVC, ou comme le 4,4'-MDI/Diisocyanate de toluène pour le polyuréthane, ainsi que pour des applications à plus petite échelle comme la production de gélatine ou le traitement du cuir. La production d'acide chlorhydrique est voisine à l'heure actuelle de 20 millions de tonnes par an (estimation en légère augmentation).