Dibrome - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Dibrome | ||||
|---|---|---|---|---|
| ||||
| Général | ||||
| No CAS | ||||
| No EINECS | ||||
| Apparence | liquide fumant ,rouge a brun, d'odeur acre. | |||
| Propriétés chimiques | ||||
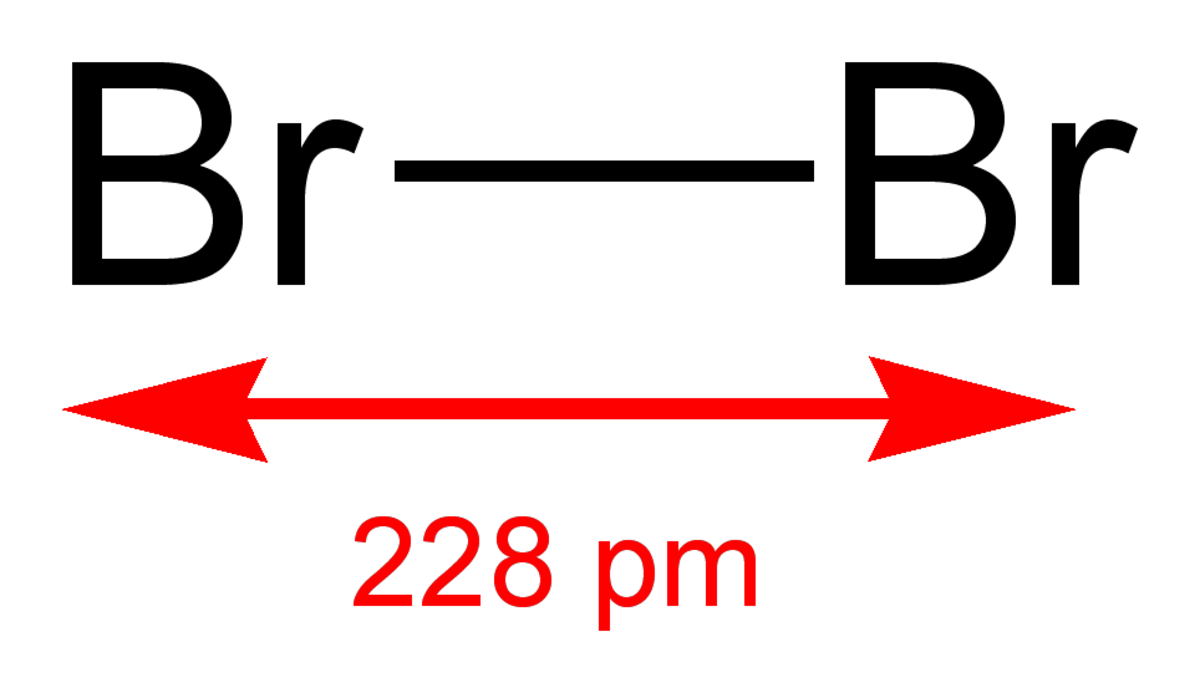
| Formule brute | Br2 | |||
| Masse molaire | 159,808 ± 0,002 g·mol-1 | |||
| Propriétés physiques | ||||
| T° fusion | -7,2 °C | |||
| T° ébullition | 58,8 °C | |||
| Solubilité | dans l'eau à 20 °C : 31 g·l-1 | |||
| Masse volumique | (eau = 1) : 3,1 g·ml-1 | |||
| Pression de vapeur saturante | à 20 °C : 23,3 kPa | |||
| Viscosité dynamique | 0,314 mm2·s-1 Viscosité cinématique à 20 °C | |||
| Point critique | 103,0 bar, 314,85 °C | |||
| Thermochimie | ||||
| Cp | ||||
| Cristallographie | ||||
| symbole de Pearson | oC8 | |||
| Classe cristalline ou groupe d’espace | Cmca (n°64) | |||
| Strukturbericht | A14 | |||
| Structure type | I2 | |||
| Précautions | ||||
| | ||||
| ||||
| Phrases R : 26, 35, 50, | ||||
| Phrases S : 1/2, 7/9, 26, 45, 61, | ||||
| | ||||
| ||||
| | ||||
|
0 3 0 OX | ||||
| | ||||


| ||||
| | ||||



Danger | ||||
| Écotoxicologie | ||||
| Seuil de l’odorat | bas : 0,0099 ppm haut : 0,46 ppm | |||
| | ||||
Le dibrome est une molécule composée de deux atomes de brome, notée Br2. C'est l'unique forme moléculaire (allotrope) de l'élément brome.
Le dibrome est un liquide toxique, lorsqu'il est en solution il est aussi appelé « eau de brome ». Il est très toxique par inhalation et provoque de graves brûlures.
Propriété oxydante
Le dibrome a un pouvoir oxydant élevé : E°(Br2/Br-) = 1,07 V.
Ainsi, l'eau de brome permet de mettre en évidence la présence d'une double liaison (voir Test au dibrome) en l'oxydant.
Précautions
Du fait de son fort pouvoir oxydant, et parce qu'il est extrêmement volatil, le dibrome dégage des vapeurs toxiques, suffocantes et rougeâtres.
Au contact de la peau, il engendre des plaies qui cicatrisent très lentement.
En cas de besoin, consulter sa fiche toxicologique sur le site de l'INRS [1]





















































