Appareil de Dean Stark - Définition
La liste des auteurs de cet article est disponible ici.
L'appareil de Dean-Stark, ou Dean-Stark, ou appareil de Dean et Stark, est un montage de verrerie de laboratoire utilisé en chimie de synthèse pour extraire l’eau (ou d’autres liquides) d'un milieu réactionnel. Il a été inventé par E. W. Dean et D. D. Stark en 1920.
Il est utilisé en association avec un réfrigérant à eau et un chauffe-ballon afin d’éliminer l’eau produite par une réaction chimique s’effectuant en chauffage à reflux.
Deux types de dispositif Dean et Stark existent, selon que la densité du solvant que l’on utilise est inférieure ou supérieure à celle de l’eau.
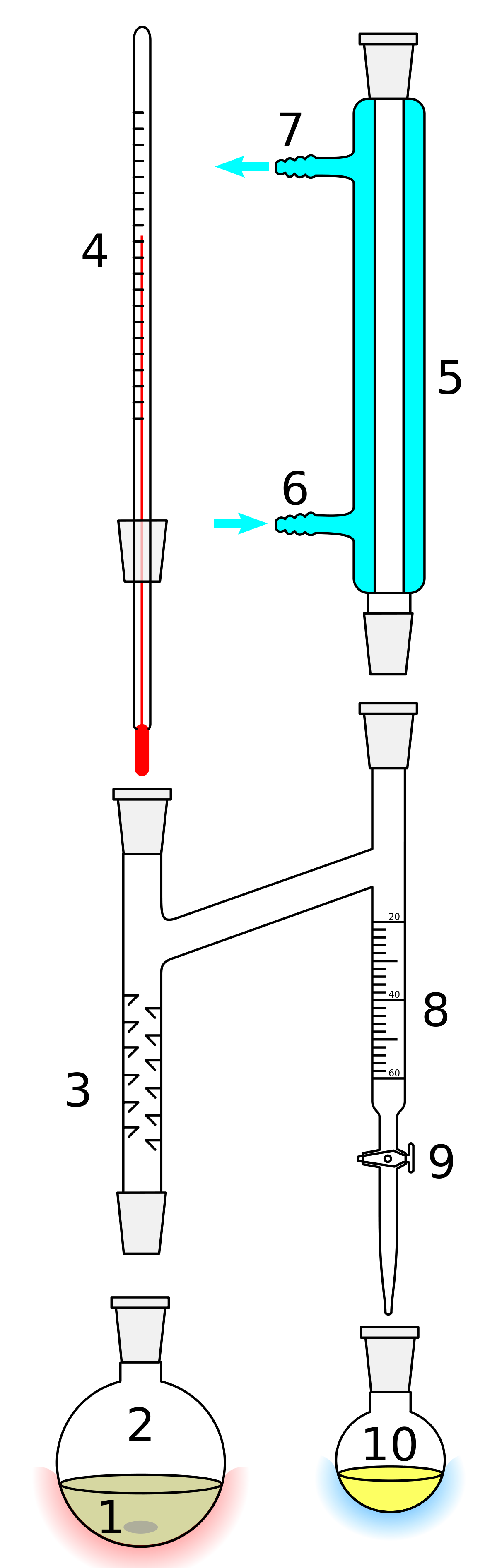
Un Dean-Stark en laboratoire se compose généralement d’un élément de verrerie cylindrique et vertical, étant généralement gradué sur toute sa longueur et se terminant par un robinet, tout comme une burette. Le haut du cylindre est ajusté au bas du condenseur à reflux, mais possède aussi un bras qui est ajusté au ballon ou réacteur contenant le milieu réactionnel.
Au cours de la réaction, des vapeurs contenant le solvant et l’espèce à extraire montent jusqu’au condenseur et, une fois liquéfiées, tombent dans le cylindre gradué. À l’intérieur de celui-ci, les liquides non-miscibles se séparent en phases. Lorsque la phase supérieure (moins dense) atteint le niveau du bras, elle coule dans celui-ci et retourne dans le ballon réacteur, alors que la phase inférieure reste dans le cylindre. Lorsque cette phase inférieure atteint elle-aussi le bras, elle pourrait elle-aussi retourner dans le réacteur, il faut donc le vider (en ouvrant le robinet) autant que nécessaire.
Ce dispositif est généralement utilisé pour la distillation azéotropique. Par exemple, pour éliminer l’eau produite par une réaction impliquant le toluène. Un mélange hétéroazéotropique de toluène et d’eau s’évapore du ballon, mais seul le toluène y retourne (étant de densité inférieure) puisqu’il flotte au-dessus de l’eau qui elle s’accumule dans la « burette ».
La méthode de Dean et Stark est souvent utilisée pour mesurer le taux d’humidité de produits tels le pain dans l’industrie agroalimentaire.
Ce dispositif peut cependant être utilisé dans des buts autres que la simple élimination de l’eau. Par exemple dans le cas de l’estérification du butanol avec de l’acide acétique catalysée par l’acide sulfurique. Les vapeurs contiennent 63 % d’ester, 24 % d’eau et 8 % d’alcool, et la phase organique recueillie contient 86 % d’ester, 11 % d’alcool et 2 % d’eau qui est réintroduite dans le milieu. La phase aqueuse est pure à 97 %.
Un autre exemple est l’estérification de l’acide benzoïque avec du butanol, où l’ester produit est isolé dans la burette, alors que le butanol, non-miscible avec l’ester, retourne dans le milieu réactionnel.
L’élimination de l’eau tout au long de ces réactions d’estérification déplace l’équilibre chimique en faveur de la formation d’ester.
Légende du schéma
1 : Barreau magnétique pour l'agitation ou pierres ponces
2 : Ballon rond à col rodé contenant le milieu réactionnel
4 : Thermomètre gradué
5 : Réfrigérant droit
6 : Entrée de l'eau de refroidissement
7 : Sortie de l'eau de refroidissement
8 : Burette
9 : Robinet
10 : Récipient de récupération du distillat