Aquaporine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction

Les aquaporines (AQP) sont une classe de protéines membranaires qui forment des « pores » perméables aux molécules d'eau dans les membranes biologiques.
Les aquaporines permettent le passage de l'eau de part et d'autre de la membrane tout en empêchant les ions de pénétrer dans la cellule. En 2009, environ 500 aquaporines ont été découvertes aussi bien dans le règne végétal qu'animal, dont 13 chez l'Homme.
Découverte
Les aquaporines n'ont été que récemment découvertes ; par Peter Agre en 1992 en injectant l'ARNm de la protéine dans un œuf de xénope alors qu'il étudiait les globules rouges et leurs parois. Il a en 2003 reçu le Prix Nobel de chimie pour ses travaux.
On supposait l'existence d'une structure de ce type car la pénétration osmotique de l'eau au travers des membranes lipidiques ne pouvait expliquer l'importance des échanges et flux observés au niveau cellulaire, des organes (reins par exemple capable de traiter l'équivalent de plusieurs centaines de litre d'eau par jour) et organismes.
Mécanisme de fonctionnement
L'eau liquide est constituée de molécules d'eau significativement liées les unes aux autres par des liaisons chimiques entre atomes d'oxygène et d'hydrogène (« liaison hydrogène »).
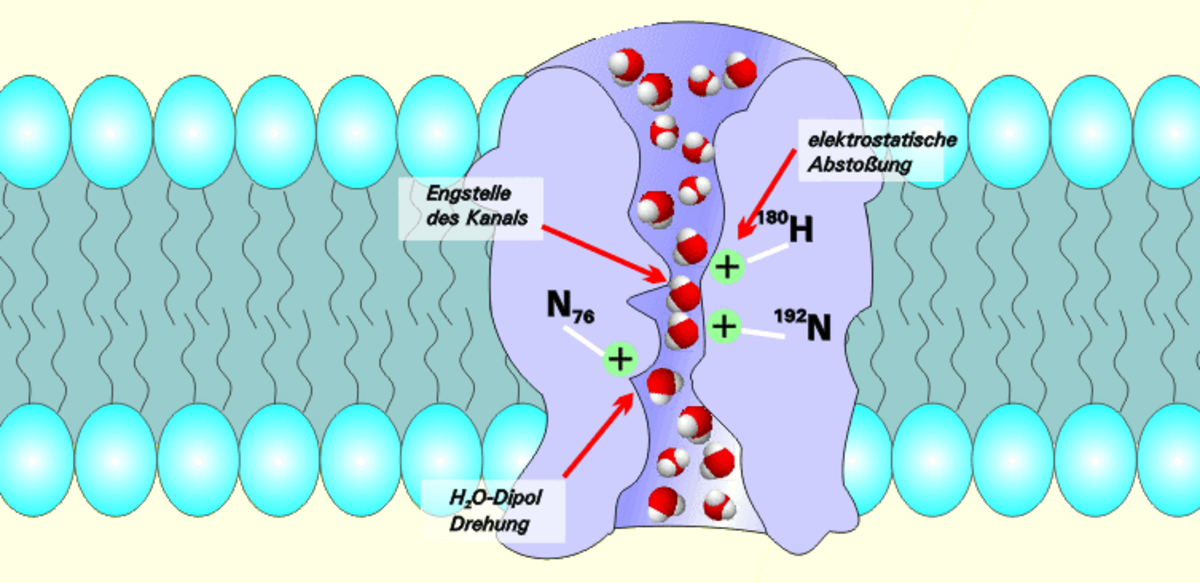
Selon les modélisations informatiques, ces molécules, lorsqu'elles entrent dans l'entonnoir du pore (canal hydrique) formé par 4 aquaporines, sont progressivement alignées alors que le pore se rétrécit (le pore a une forme de sablier). Les forces électrostatiques faibles résultant de la configuration interne du pore positionnent alors chaque molécule d'eau dans une même position : atome d'oxygène en premier. Arrivée au centre du canal chaque molécule d'eau est individuellement happée par l'attraction chimique de certains acides aminés qui tapissent l'intérieur du pore. Elle est ensuite retournée sur elle-même (par interaction avec deux asparagines présentes à l'entrée de l'étranglement). Ce retournement brutal de la molécule casse pour un instant la liaison hydrogène, isole la molécule du flux cohérent de la file des molécules d'eau, et la pousse vers la sortie du pore (cette fois les atomes d’hydrogène positionnés vers la sortie). Seule les molécules d'eau et certains solutés passent ce type de "porte". Les ions hydrogène (ions hydronium en solution aqueuse parfois appelés protons) qui constituent la réserve énergétique de la cellule sont eux repoussés bien que plus petits et solubles dans l'eau ; ces pores sont totalement étanches aux protons, permettant aux cellules de conserver leur potentiel électrochimique.
- Voir une animation décrivant le trajet et retournement des molécules d'eau traversant un pore constitué d'aquaporines (fichier Mpeg assez lourd. ADSL recommandée).
Description
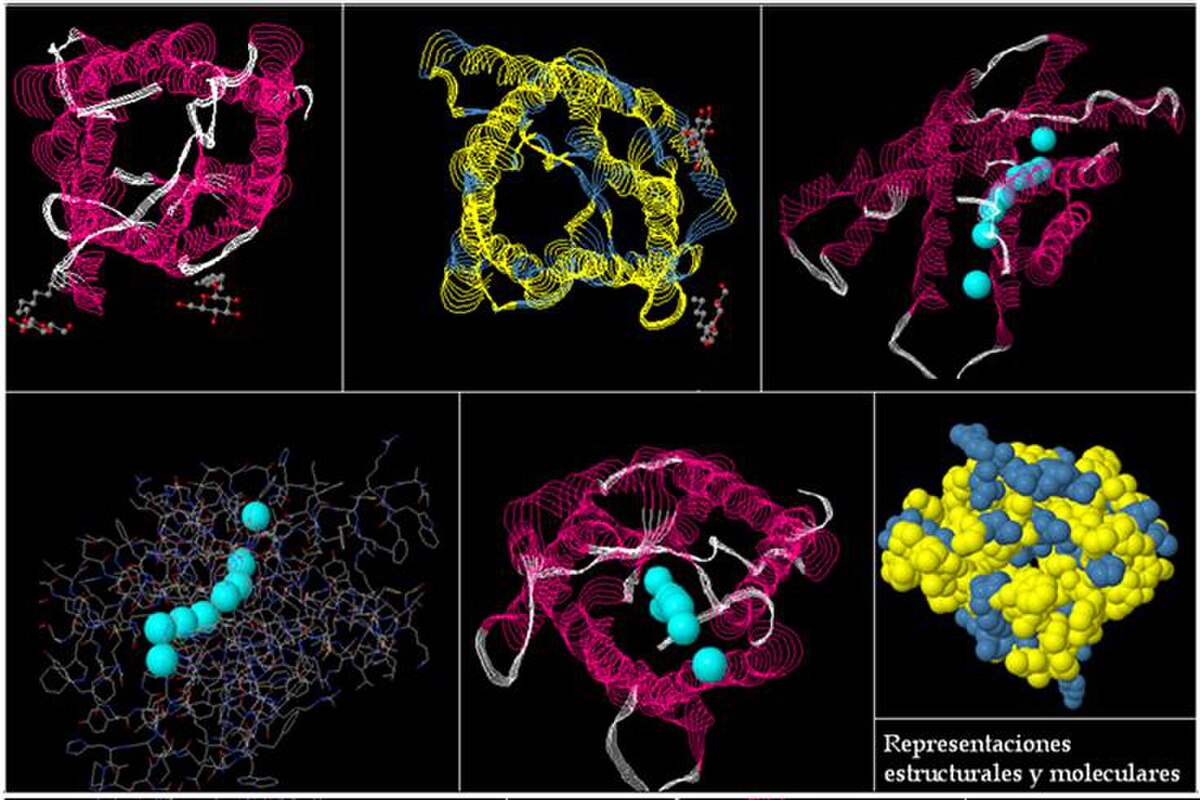
Ce sont des protéines de 250 à 300 acides aminés et 25 à 35 kD (kilo Dalton). Elles sont constituées de 6 hélices alpha s'insérant dans la bicouche lipidique constituante de la membrane. Ces 6 hélices sont reliées par des boucles d'acides aminés dont 3 particulièrement importantes se trouvent au milieu des boucles B et E : NPA (N pour asparagine, P pour proline et A pour alanine).
C'est face à ce motif NPA que la cassure des ions H+ peut se faire : les deux boucles interagissent pour former une septième hélice créant un étranglement de 3 Ångströms de diamètre dans le canal qui constitue le pore.
Les aquaporines sont des homotétramères indépendants, c'est-à-dire qu'elles sont composées de 4 monomères capables de transporter les molécules d'H2O individuellement. On pourrait les comparer à un sablier qui ferait passer une à une les molécules.