Proline - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Proline | |
|---|---|
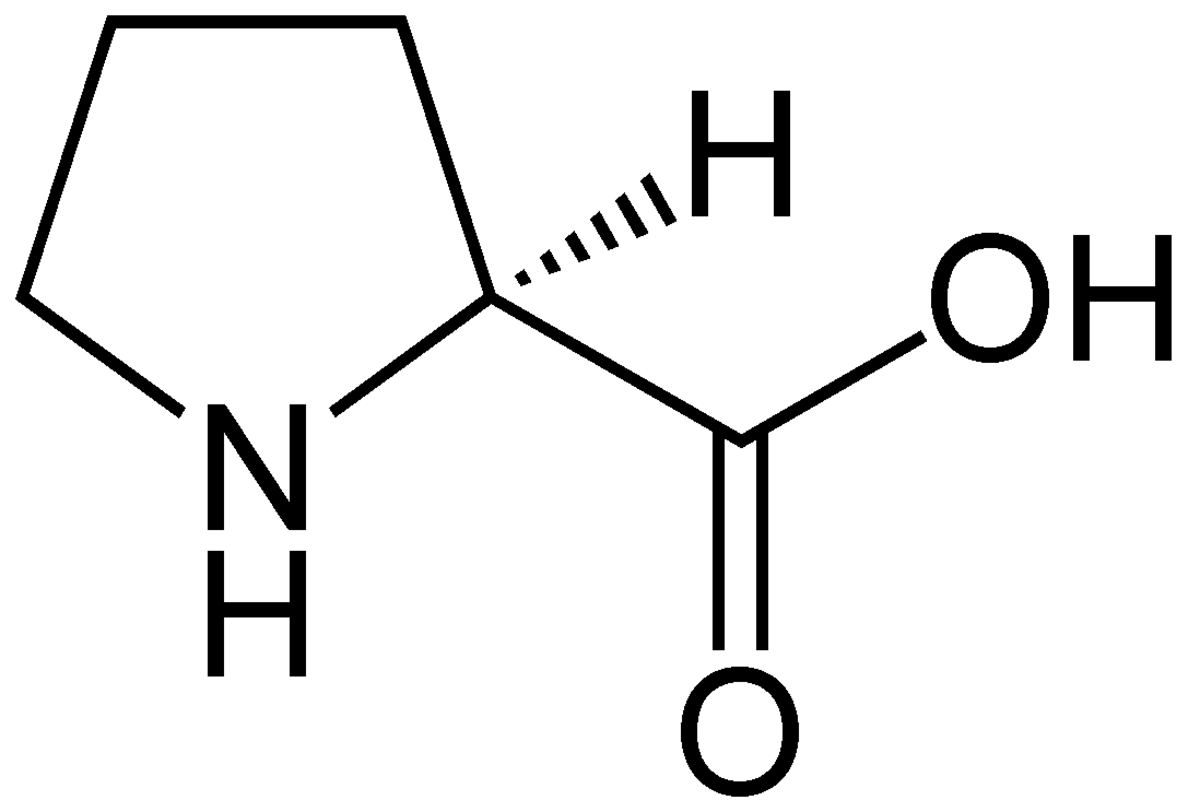
| |
| Général | |
| Nom IUPAC | |
| Synonymes | P, Pro |
| No CAS | (racémique) (L) ou S(–) (D) ou R(+) |
| No EINECS | (L) |
| FEMA | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C5H9NO2 |
| Masse molaire | 115,1305 ± 0,0054 g·mol-1 |
| pKa | 6,30 |
| Propriétés biochimiques | |
| Codons | CCA, CCU, CCG, CCC |
| Précautions | |
| | |
| Produit non contrôlé | |
| | |
La L-proline ou proline par abus de langage, est l'un des 20 acides aminés du code génétique. Au sein des protéines humaines, sa fréquence est de 5,2%.
La L-proline (énantiomère de configuration absolue S) sert aussi aux organismes vivants pour assembler les protéines. On parle ainsi d'acides aminés protéinogènes.
La proline peut agir en brisant les hélices α car elle ne peut former de liaison hydrogène (du fait de son amine secondaire) et déstabilise donc l'hélice α, ou former une bifurcation dans les feuillets β. La présence de nombreuses prolines peut être à l'origine d'une hélice à proline (c'est notamment le cas du collagène). La proline possède une fonction amine secondaire et non pas une fonction imine (L'erreur est présente dans certains ouvrages francophones de biochimie. Mais n'oublions pas que la chimie et la biochimie ne sont jamais en contradiction de vocabulaire concernant les fonctions chimiques).
La proline participe essentiellement à la synthèse du collagène et à la cicatrisation.
Données
- Force de van der Waals : 90
- pK1 (α-COOH) : 1,95
- pK2 (αN-H) : 10,64
La proline contient dans sa molécule une fonction amine secondaire cyclique.
Un autre acide aminé l'hydroxyproline dérive de la proline par hydroxylation en 4.

















































