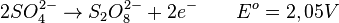Électrolyse de l'eau - Définition
La liste des auteurs de cet article est disponible ici.
Choix de l'électrolyte
L'eau pure conduit peu l'électricité, ce qui conduit à l'emploi d'un additif hydrosoluble - électrolyte - dans la cellule d'électrolyse pour « fermer » le circuit électrique (autrement dit, faire en sorte que les potentiels chimiques en jeu permettent la réaction chimique). L'électrolyte se dissout et se dissocie en cations et anions (c'est-à-dire respectivement des ions chargés positivement et négativement) qui peuvent « porter » le courant. Ces électrolytes sont habituellement des acides, des bases ou des sels.
Une attention particulière doit être portée au choix de l'électrolyte : en effet, l'anion apporté est en compétition directe avec les ions hydroxydes pour la perte d'électron. Un électrolyte anionique avec un potentiel standard d'électrode inférieur à celui de l'hydroxyde sera oxydé à sa place, ne produisant donc pas de dioxygène. De manière similaire, un cation avec un potentiel standard d'électrode supérieur à celui de l'ion hydrogène sera réduit à sa place, et donc il n'y aura pas de production de dihydrogène.
Les cations suivants ont des potentiels d'électrode inférieurs à celui de H+, et sont par conséquent acceptables pour un usage en tant que cations d'électrolyte : Li+, Rb+, K+, Cs+, Ba2+, Sr2+, Ca2+, Na+, et Mg2+, soit des alcalins ou alcalino-terreux. Le sodium et le lithium, qui forment des sels solubles et peu chers, sont les plus fréquemment utilisés.
Si un acide est utilisé comme électrolyte, le cation libéré est H+ et il n'existe alors pas de compétition avec H+ libéré par la dissociation de l'eau. Dans ce cas de figure, l'anion le plus communément utilisé est SO2- (l'acide ajouté est l'acide sulfurique HSO), très difficile à oxyder. Le potentiel standard d'oxydation de cet ion en ion peroxydisulfate est de 2,05 V. À l'anode :
D'autres acides forts sont fréquemment utilisés comme électrolytes.
Efficacité et rendement
Le rendement énergétique de l'électrolyse de l'eau peut varier de manière importante. La gamme de rendement varie entre 50-70 % [1], quand d'autres indiquent 80-94% [2]. Ces valeurs se réfèrent seulement au rendement de la conversion de l'énergie électrique en énergie chimique de l'hydrogène. L'énergie perdue lors de la génération de l'électricité n'est pas comptabilisée. Ainsi, lorsque l'on considère une centrale nucléaire convertissant la chaleur des réactions nucléaires en hydrogène par électrolyse, le rendement total est de l'ordre de 25-40 % [3].
Un blocage cinétique impose une grande tension électrique pour obtenir une intensité décente, et donc un rendement significatif.
Applications
Environ quatre pour cent du dihydrogène gazeux produit dans le monde est produit par électrolyse, et habituellement utilisé sur place. Le dihydrogène est utilisé pour la synthèse d'ammoniac comme engrais par le procédé Haber-Bosch, et pour la conversion du pétrole lourd en fractions plus légères par hydrocraquage.