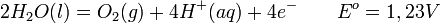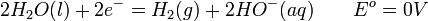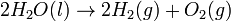Électrolyse de l'eau - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L’électrolyse de l'eau est un procédé électrolytique qui décompose l'eau en dioxygène et dihydrogène gazeux avec l'aide d'un courant électrique, pour lequel, dans l'enseignement, une source de tension de 6 volts est couramment utilisée. La cellule électrolytique est constituée de deux électrodes - habituellement en métal inerte (dans la zone de potentiel et de pH considérée) comme le platine- immergées dans un électrolyte (ici l'eau elle-même) et connectées aux pôles opposés de la source de courant continu.
Historique
La première électrolyse de l'eau a été réalisée le 2 mai 1800 par deux chimistes britanniques, William Nicholson (1753 - 1815) et Sir Anthony Carlisle (1768-1840), quelques jours après l'invention de la première pile électrique (publication soumise le 20 mars 1800 dans une lettre en français au président de la Royal Society, Joseph Banks) par Alessandro Volta.
Spontanéité du processus
La décomposition de l'eau en dihydrogène et dioxygène dans les conditions normales de température et de pression n'est pas favorisée thermodynamiquement, les potentiels standard des deux demi-réactions étant négatifs.
d'autre part, l'énergie libre de Gibbs pour le processus dans des conditions standard est à valeur largement positive (environ 474,4 kJ). Ces considérations rendent la réaction « impossible » à effectuer sans ajouter des électrolytes en solution.
Principe et description du processus
Le courant électrique dissocie la molécule d'eau (soit HO) en ions hydroxyde (OH)- et hydrogène H+ : dans la cellule électrolytique, les ions hydrogène acceptent des électrons à la cathode dans une réaction d'oxydation en formant du dihydrogène gazeux (soit H), selon la réaction de réduction:
-
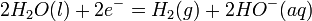
alors qu'une oxydation des ions hydroxyde - qui perdent des électrons donc - se produit à l'anode afin de "fermer" le circuit électrique (équilibre de la réaction chimique en charges) :
-
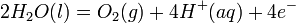
ce qui donne l'équation de décomposition par électrolyse suivante :
La quantité de dihydrogène gazeux produite est donc deux fois celle de dioxygène. Selon la loi d’Avogadro, le volume récupéré d'hydrogène produit est aussi deux fois plus important que celui de l'oxygène.
Techniques
Cette expérience est simple à répéter. Deux électrodes reliées aux pôles d'une pile et plongées dans un verre d'eau additionnée d'un peu d'électrolyte est suffisant pour produire un « courant » visible de bulles de dihydrogène ou de dioxygène à chaque électrode. La présence d'ions hydroxyde (OH-) peut être détectée par un indicateur de pH comme la phénolphtaléine ou le bleu de bromothymol.

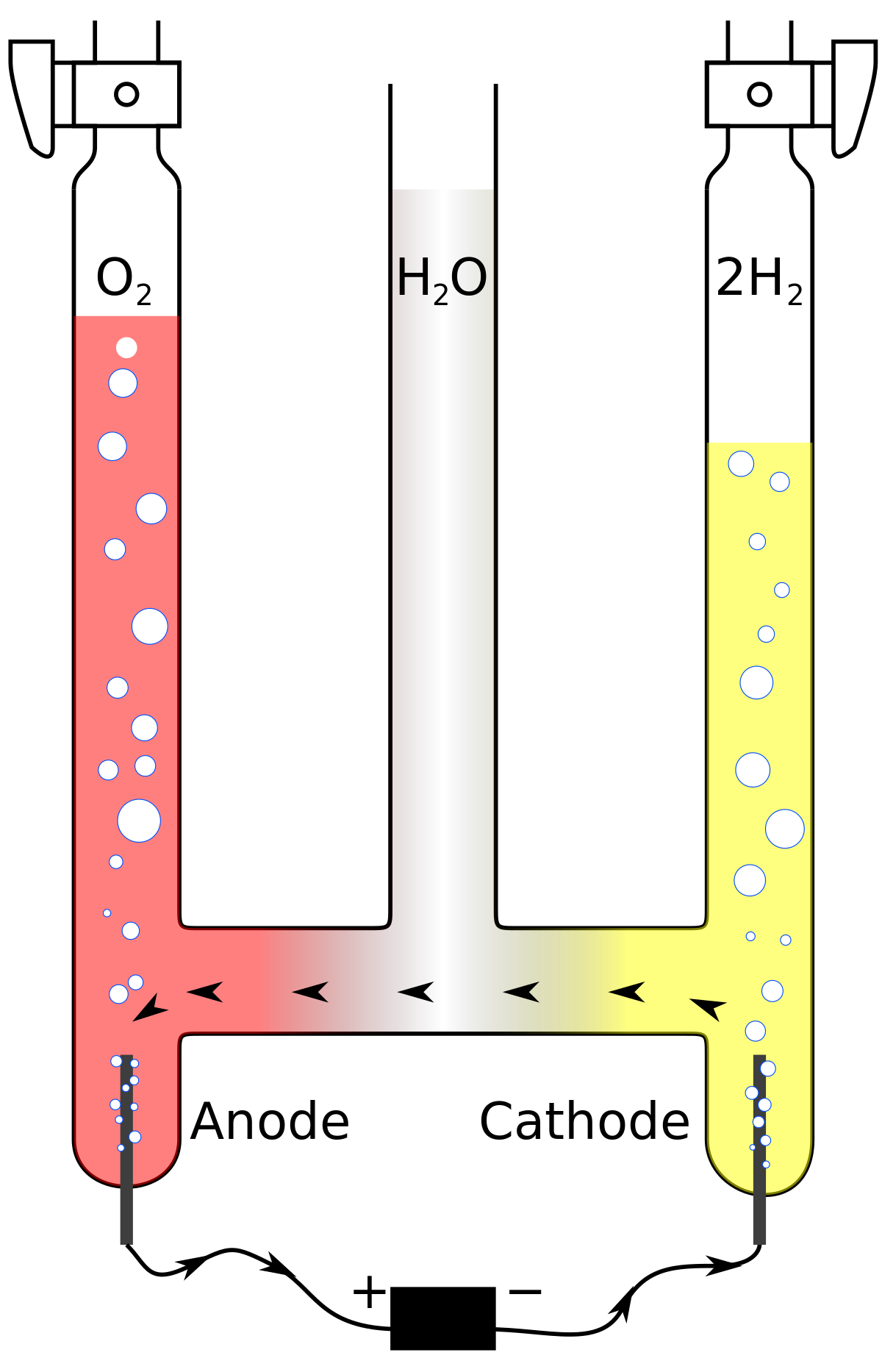
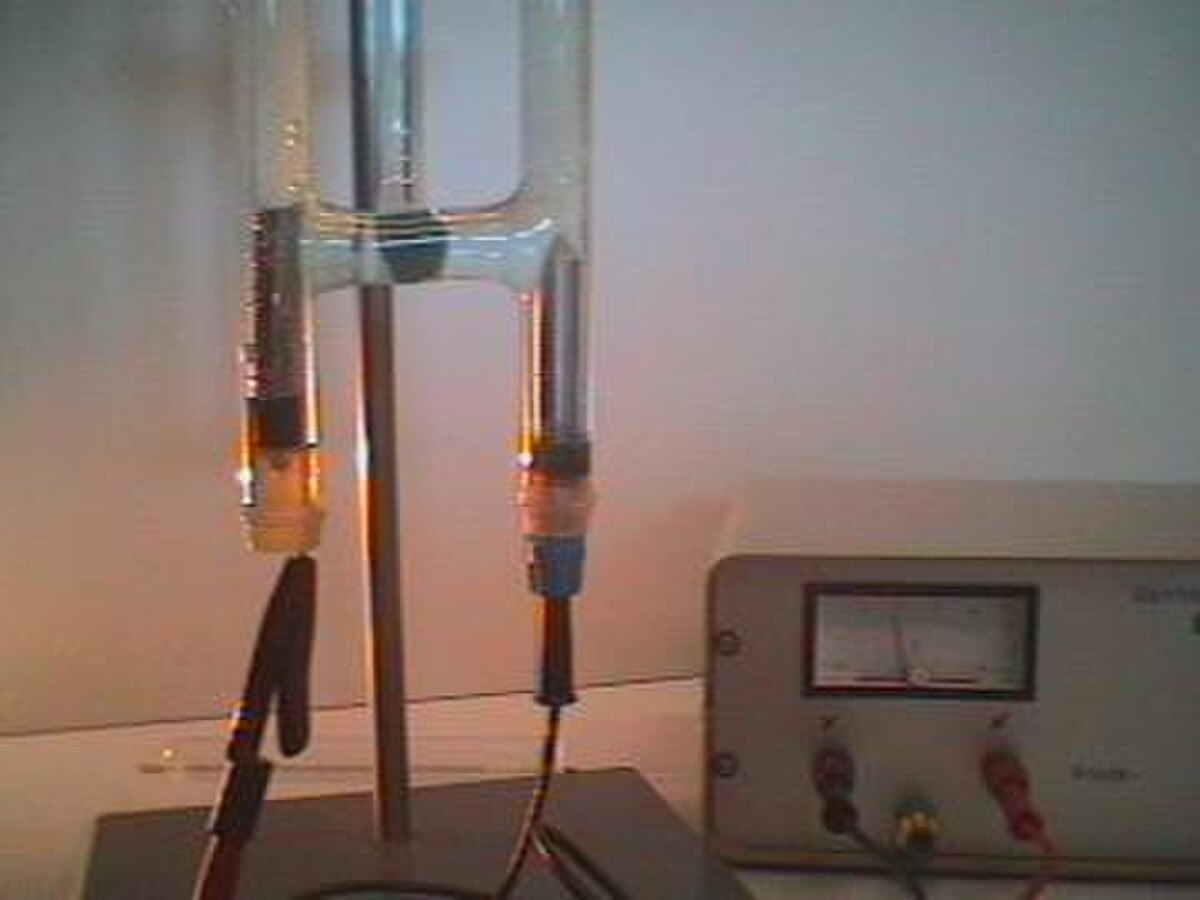
Voltamètre d'Hoffmann
Le voltamètre d'Hoffmann est parfois utilisé comme cellule électrolytique de taille réduite. Il consiste en trois tubes joints par la base. Le cylindre médian est ouvert en haut pour permettre l'addition d'eau et d'électrolyte. Une électrode de platine est placée à l'intérieur de chacun des tubes latéraux, plus précisément à leur base, et connectée à un des deux pôles d'une source d'électricité. Lorsque le courant passe au travers du voltamètre d'Hofmann, du dioxygène gazeux se forme à l'anode et du dihydrogène à la cathode. Chaque gaz déplace l'eau et peut être collecté à l'extrémité des deux tubes latéraux.
Électrolyse industrielle
De nombreuses cellules électrolytiques industrielles sont tout à fait similaires au voltamètre d'Hofmann, avec des disques ou des volumes en « ruches d'abeilles » de platine comme électrodes. L'hydrogène est habituellement « créé », collecté et brûlé sur place, son énergie volumique étant trop faible pour être stocké ou transporté de manière économiquement rentable. L'oxygène gazeux est traité comme un sous-produit.
Électrolyse à haute température
L'électrolyse à haute température (connue aussi sous le sigle HTE - high-temperature electrolysis, ou électrolyse en phase vapeur) est une méthode qui est actuellement étudiée pour l'électrolyse de l'eau par machine thermique. L'électrolyse à haute température est plus efficace que le procédé à température ambiante puisqu'une partie de l'énergie nécessaire à la réaction est apportée via la chaleur, moins chère à obtenir que l'électricité, et que les réactions d'électrolyse ont un meilleur rendement à haute température.