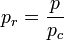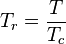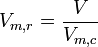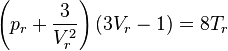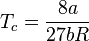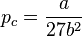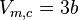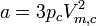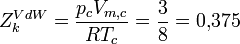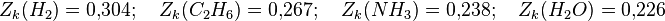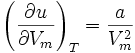Équation d'état de Van der Waals - Définition
La liste des auteurs de cet article est disponible ici.
Forme réduite
Les grandeurs réduites utilisent le point critique de chaque gaz comme point de comparaison, en divisant les grandeurs d'état par leur expression critique. Elles sont adimensionnelles et définies comme suit :
- Pression réduite :
- Température réduite :
- Volume molaire réduit :
Deux gaz de grandeurs réduites semblables ont des propriétés proches.
On peut également formuler l'équation de Van der Waals réduite :
|
Estimations des grandeurs critiques
Le point critique joue un rôle important pour les gaz réels. On peut définir les grandeurs et relations suivantes à partir de l'équation de Van der Waals :
- Température critique :
- Pression critique :
- Volume molaire critique :
- Combinaison du volume molaire critique et de la pression critique :
Lorsque l'on introduit ces grandeurs dans l'équation d'état, on fait apparaître une nouvelle constante :
Zk est appelé facteur de compressibilité critique. Dans l'équation de Van der Waals, cette grandeur est constante, mais cela ne correspond pas au comportement de gaz réels. En règle générale, le facteur de compressibilité critique vaut de 0,25 à 0,3. La déviation observée montre le caractère approchée de l'équation de Van der Waals.
On a par exemple :
Énergie interne
L'énergie interne d'un gaz de Van der Waals dépend du volume molaire :
Elle n'est pas uniquement composé de l'énergie cinétique des molécules, mais également de l'énergie potentielle des forces de cohésion, décrites par le paramètre a.