Fluorure d'aluminium - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
| Fluorure d'aluminium | |||
|---|---|---|---|
| |||
| Général | |||
| Synonymes | Trifluorure d'aluminium | ||
| No CAS | (anhydre) (monohydrate) (trihydrate) | ||
| No EINECS | (anhydre) | ||
| Apparence | cristaux incolores a blancs hygroscopiques. | ||
| Propriétés chimiques | |||
| Formule brute | AlF3 | ||
| Masse molaire | 83,9767482 ± 2,3E-6 g·mol-1 101.992 (monohydrate) 138.023 (trihydrate) | ||
| Propriétés physiques | |||
| T° fusion | trihydrate décomp 220 °C, Point de sublimation : 1 272 °C | ||
| Solubilité | dans l'eau à 20 °C : 5 g·l-1 | ||
| Masse volumique | 2,9 g·cm-3 | ||
| Pression de vapeur saturante | à 1 238 °C : 133 Pa | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | ≤ 15,45 eV (gaz) | ||
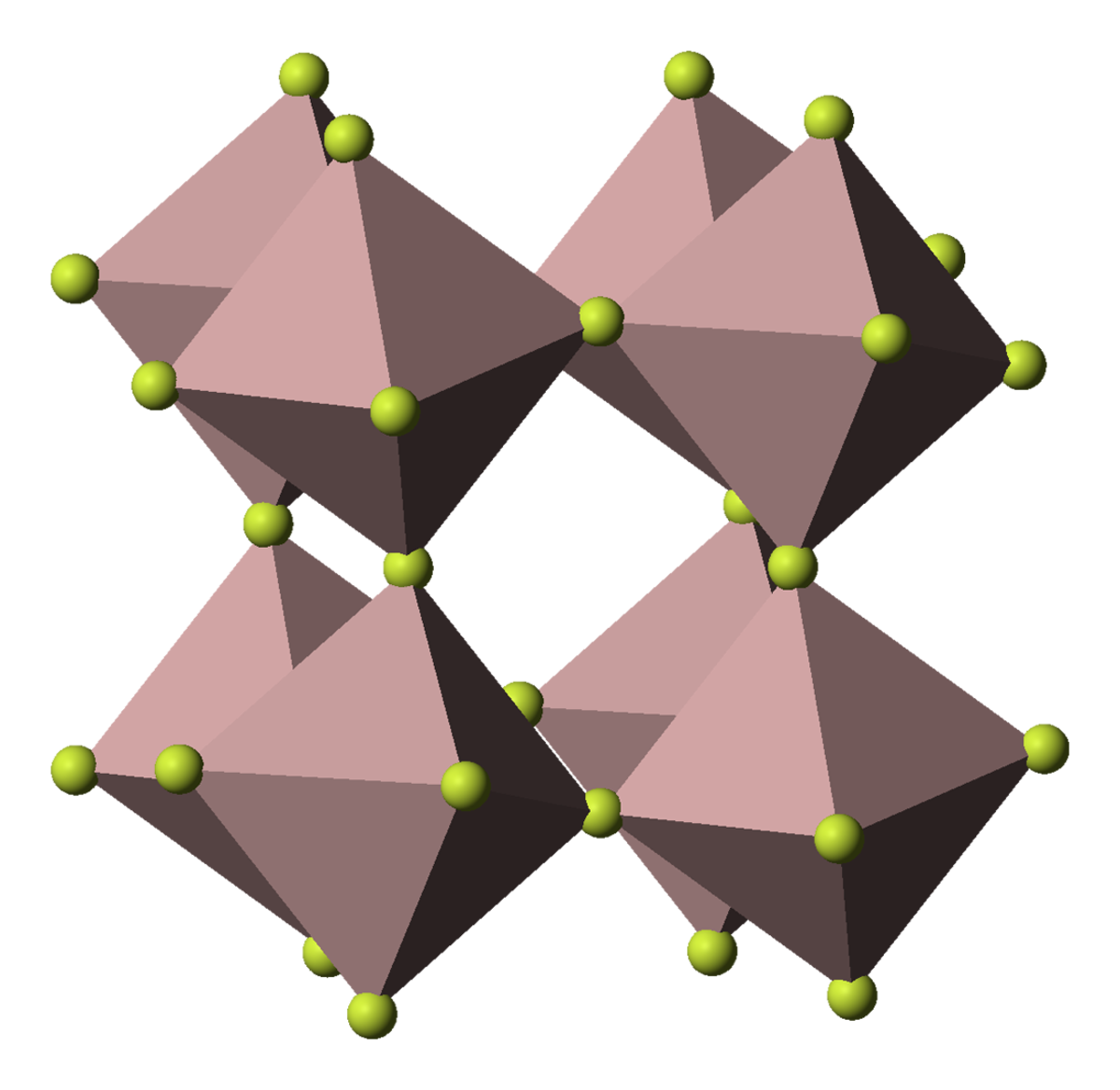
| Cristallographie | |||
| symbole de Pearson | hR8 | ||
| Classe cristalline ou groupe d’espace | R32 (n°155) | ||
| Strukturbericht | D014 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 22, 36/37/38, | |||
| Phrases S : 26, | |||
| | |||
| |||
| | |||
Trifluorure d'aluminium :
Trifluorure d'aluminium trihydraté : 
| |||
| | |||
Le fluorure d'aluminium est un solide ionique composé de l'ion fluorure (formule : F-) et de l'ion aluminium (formule : Al3+). Comme un solide ionique est électriquement neutre, alors il faut trois ions fluorure pour équilibrer un ion aluminium. Ainsi la formule du fluorure d'aluminium est (Al3+ + 3F-) = AlF3.