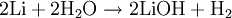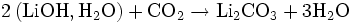Hydroxyde de lithium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Hydroxyde de lithium | |||||
|---|---|---|---|---|---|
| Général | |||||
| Nom IUPAC | |||||
| No CAS | (anhydre) (monohydrate) | ||||
| No EINECS | |||||
| SMILES | |||||
| InChI | |||||
| Apparence | cristaux incolores, hygroscopiques. (monohydrate) | ||||
| Propriétés chimiques | |||||
| Formule brute | LiOH | ||||
| Masse molaire | 23,948 ± 0,002 g·mol-1 | ||||
| pKb | -2,36 | ||||
| Moment dipolaire | 4,754 ± 0,002 D | ||||
| Propriétés physiques | |||||
| T° fusion | 450 à 471 °C (monohydrate) | ||||
| T° ébullition | (décomposition) : 924 °C (monohydrate) | ||||
| Solubilité | dans l'eau à 20 °C : 109 g·l-1 (monohydrate), 128 g·l-1 (20 °C,eau) | ||||
| Masse volumique | anhydre 2,54 solide, monohydrate 1,51 | ||||
| Thermochimie | |||||
| S0 | 42.81 J.K-1.mol-1 | ||||
| ΔH0 | -484.93 kJ/mol | ||||
| ΔH° | 188 kJ·mol-1 (1 atm, 1 626 °C) | ||||
| Précautions | |||||
| | |||||
| |||||
| | |||||

| |||||
| | |||||
L’hydroxyde de lithium (LiOH, CAS : 1310-65-2), aussi appelé lithine, est une base corrosive, produite lors du mélange de lithium et d'eau :
Il est analogue à la soude (NaOH) et la potasse (KOH), bien que certaines de ses propriétés soient uniques. Son principal avantage par rapport à celles-ci concerne sa faible masse et sa plus grande densité, ce qui rend ses utilisations en milieu confiné plus pratiques.
Propriétés
L'hydroxyde de lithium se présente sous la forme d'un cristal blanc hygroscopique. Il est soluble dans l'eau (128 g·l-1 à 20 °C), et faiblement dans l'éthanol. Il fond à 471 °C.
Utilisations
L'hydroxyde de lithium est utilisé lors des missions spatiales et dans les sous-marins pour purifier l'air. En effet, l'hydroxyde de lithium réagit avec le dioxyde de carbone :
D'autres utilisations le font intervenir dans les synthèses de polymères ou comme électrolyte dans les accumulateurs.
Il est également utilisé par l'industrie nucléaire pour le conditionnement des circuits : il vient y contrer l'acidité de l'acide borique (lui-même injecté comme neutrophage). Le choix s'est porté sur lui car une faible partie du bore 10 se transforme en Lithium par réaction B(n, alpha)Li (environ 2%).