Acide borique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide borique | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | Acide boracique Acide orthoborique | |
| No CAS | ||
| No EINECS | ||
| Code ATC | S02 | |
| No E | E284 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux incolores ou poudre blanche sans odeur. | |
| Propriétés chimiques | ||
| Formule brute | H3BO3 | |
| Masse molaire | 61,833 ± 0,008 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 171 °C (décomposition) | |
| Solubilité | 47,2 g·l-1 (eau, 20 °C) | |
| Masse volumique | 1,435 g·cm-3 (15 °C) | |
| Pression de vapeur saturante | 2,7 mbar à 20 °C | |
| Thermochimie | ||
| S0 | 295,23 J.mol-1•K | |
| S0 | 88,7 J.mol-1•K | |
| ΔH0 | -992,28 kJ.mol-1 | |
| ΔH0 | -1093,99 kJ.mol-1 | |
| Précautions | ||
| | ||
| ||
| Phrases R : 60, 61, | ||
| Phrases S : 45, 53, | ||
| | ||

| ||
| | ||
| Danger | ||
| Peau | irritations possibles | |
| Yeux | irritations possibles | |
| Ingestion | ||
| | ||
L'acide borique (acide boracique ou acide orthoborique) est un acide faible souvent employé comme antiseptique, insecticide, absorbeur de neutron, dans les centrales électro nucléaires pour contrôler le taux de fission de l'uranium, et comme précurseur d'autres composés chimiques.
Il existe sous forme de cristaux incolores ou de poudre blanche se dissolvant dans l'eau.
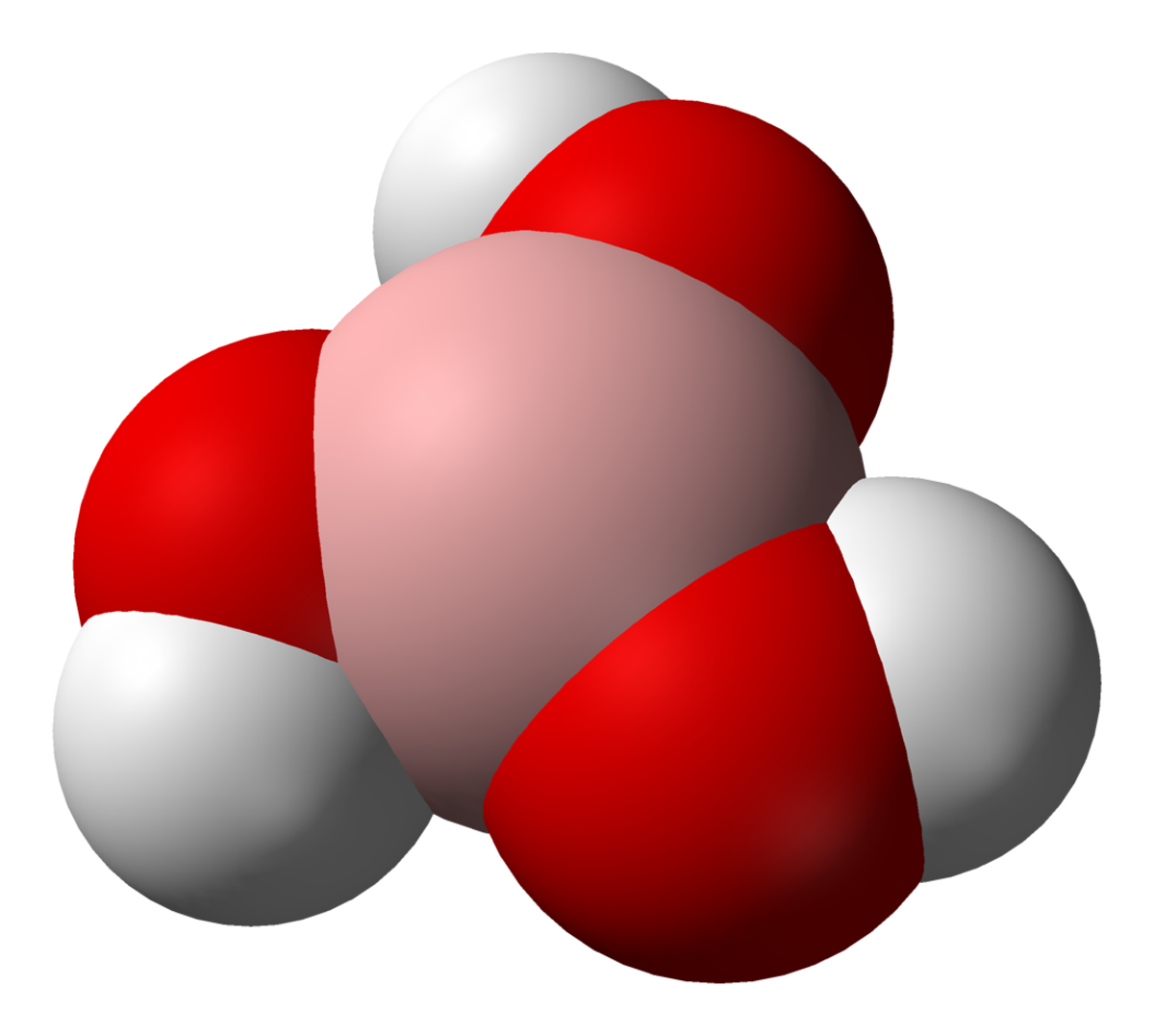
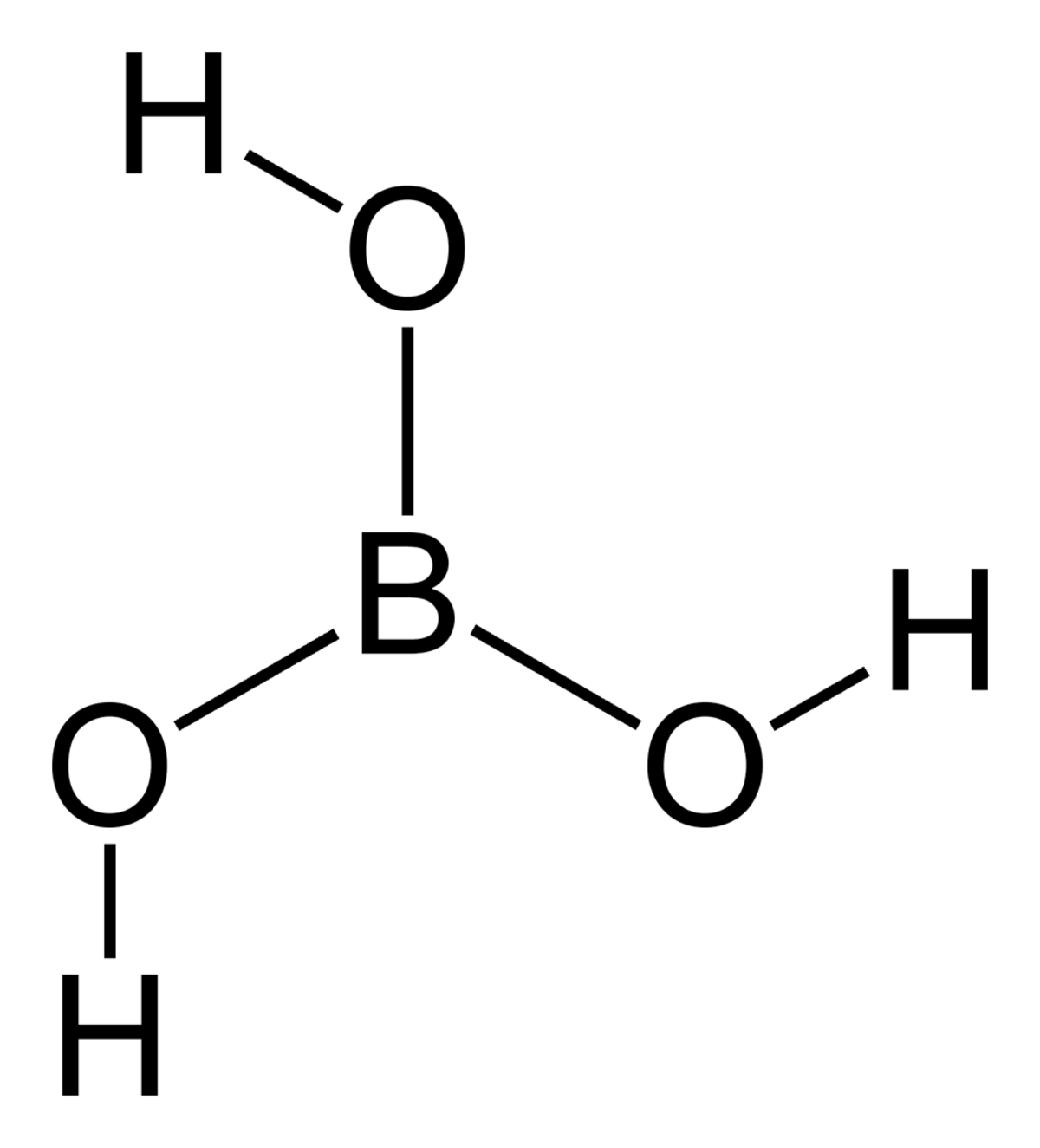
Sa formule brute est la suivante H3BO3 ou B(OH)3. Quand il se présente sous forme de minerai, on le désigne sous le nom de sassolite.
Fabrication
L'acide borique est produit principalement à partir des minerais de borate par sa réaction avec l’acide sulfurique. La plus grande source de borates dans le monde est une mine à ciel ouvert située à Boron, Californie, USA.
L'acide borique a été produit pour la première fois par Wilhelm Homberg (1652-1715) à partir du borax, sous l'action d’acides minéraux, et a reçu le nom de « sal sedativum Hombergi ».
Propriétés
L'acide borique est soluble dans l’eau bouillante. Au-dessus de 170 °C il se déshydrate, formant l’acide métaborique HBO2. L'acide métaborique est un cristal cubique, blanc et légèrement soluble dans l'eau. Il fond à environ 236 °C, et une fois chauffé au-dessus de 300 °C se déshydrate, formant l' acide tétraborique ou l’acide pyroborique, H2B4O7. Le terme d’acide borique peut se rapporter à l’un ou l’autre de ces composés. À une température plus élevée il se forme du trioxyde de bore. L'acide borique ne se dissocie pas en solution aqueuse, mais son activité acide est due à son interaction avec les molécules d’eau :
-
- B(OH)3 + H2O = B(OH)4−+ H+
- Ka = 5.8x10−10 mol/l; pKa = 9.24.
- B(OH)3 + H2O = B(OH)4−+ H+
Des anions polyborate se forment à pH 7,10 si la concentration en bore est au-dessus de 0,025 mol/L. Le plus connu de ces derniers est l'ion tétraborate, trouvé dans le borax minéral :
-
- 4B(OH)4− + 2H+ = B4O72− + 9H2O