Maladie d'Alzheimer - Définition
La liste des auteurs de cet article est disponible ici.
Étiologie
Génétique de la maladie d'Alzheimer
Formes génétiques
Moins de 1 % des malades présentent une maladie d'Alzheimer d'origine purement génétique. Cette forme se caractérise par :
- l'apparition des signes avant 30 ans ;
- une transmission autosomique dominante (la moitié de chaque génération est atteinte).
Deux mutation de gènes sont impliqués :
- une mutation du gène APP situé sur le chromosome 21 qui code un précurseur de la protéine amyloïde (cinq mutations du codon 717 sont connues) ;
- une mutation du gène PSEN1 situé sur le chromosome 14 (nombreuses mutations qui sont des mutations faux-sens).
Prédispositions génétiques
Les formes dites sporadiques, c'est-à-dire non-familiales, semblent souvent comporter une prédisposition génétique :
- En 1993, l' APOE4 (l'allèle 4 du gène de l'apolipoprotéine E) a été démontré significativement lié à une augmentation de risque de la maladie d'Alzheimer. Mais la présence de l' APOE4 n'est ni nécessaire ni suffisante pour développer la pathologie ;
Le gène de l'apolipoprotéine E est présent sous trois formes alléliques : l'APOE2, APOE3, et APOE4. Le premier se rencontre dans 51% de la population, le deuxième se rencontre dans 80 % de la population et le troisième se rencontre dans 15 % de la population ;
- - la présence de l' APOE4 sous la forme hétérozygote (1 allèle APOE4) multiplie par 2 le risque de maladie d'Alzheimer (par rapport aux personnes ne possédant pas cet allèle) ;
- - la présence de l' APOE4 sous la forme homozygote (2 allèles APOE4) multiplie par 11 le risque de maladie d'Alzheimer (par rapport aux personnes ne possédant pas cet allèle).
Cette apolipoprotéine E interviendrait dans les mécanismes de réparation neuronale.
- En 2009, le gène de la clusterine a été ajouté à ce début de liste
- En 2009, toujours, un gène codant la protéine PICALM (phosphatidylinositol-binding clathrin assembly protein) contribuant au système immunitaire, CR1 (récepteur 1 du composant 3b/4b du complément) a aussi été ajouté fortement suspecté.
Anatomo-pathologie
Le cerveau du patient est victime d'un double processus de dégénérescence et d’inflammation, caractérisé par deux types de lésions locales participant à une lésion plus globale du cerveau :
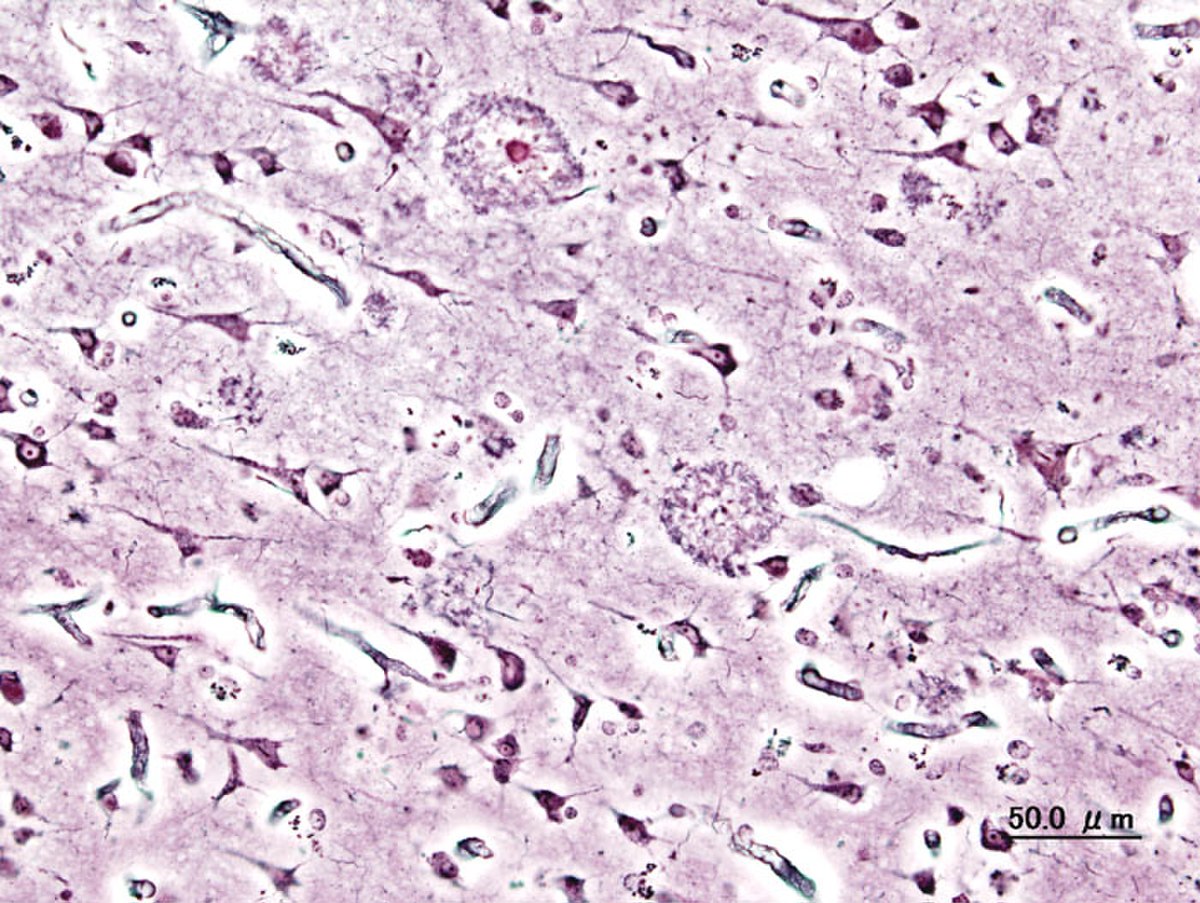
Les plaques séniles (ou plaques amyloïdes)
Ces plaques, essentiellement localisées dans le néocortex et l'hippocampe, correspondent à l'accumulation extracellulaire d’un peptide dit « β-amyloïde » (PbA) ou « peptide Aβ42 » (42, parce que constituée de 42 acides aminés). Cette protéine est en fait la forme clivée et anormale d'une glycoprotéine membranaire dite « protéine précurseur de la protéine β-amyloïde » (ou APP). C'est une protéine pathogène (neurotoxique) et insoluble qui est aussi la forme la plus amyloïdogène du bêta-amyloïde. C'est une enzyme, la β-secretase qui provoque, pour des raisons encore mal comprises, le clivage anormal de la protéine APP (Amyloïd Protein Precursor).
En temps normal cette protéine de la membrane des neurones est clivée par des secretases en peptide p3 non neurotoxique. La responsabilité de toxiques tels que le mercure accumulé dans le cerveau sous sa forme ionisée divalente (Hg2+ ; pro-oxydant, à forte affinité pour les groupements soufrés thiols) est suspectée... voir plus bas le chapitre consacré à l'épidémiologie de la maladie).
Cette anomalie permettrait une entrée anormale de calcium dans le neurone, ce qui activerait la microglie (réaction inflammatoire), entraînant la mort inéluctable du neurone par nécrose ou par apoptose.
Les dégénérescences neurofibrillaires
Des lésions cellulaires semblent consécutives à une augmentation de la capacité de phosphorylation (estérification des fonctions alcool des acides aminés hydroxylés) de la protéine Tau (macromolécule essentielle à la stabilité de la tubuline (protéine constituant majoritairement l'assemblage des microtubules qui forment le cytosquelette des axones neuronaux)). Ces lésions semblent induites par l'accumulation anormale d'un dérivé de la protéine tau hyperphosphorylée, responsable de la formation de filaments appariés : Quand la protéine tau est hyperphosphorylée, elle se détache des microtubules, et va se conformer en paire de filaments hélicoïdaux pathologiques, qui s'agrégent en amas de neurofibrilles causant une neurodégénérescence fibrillaire progressive. Les substances nécessaires au fonctionnement du neurone ne pouvant plus être acheminées jusqu'au corps cellulaire, le neurone finit par mourir.
L’atrophie corticale
Chez les patients atteints de la maladie d'Alzheimer, le cerveau peut perdre 8 à 10 % de son poids tous les dix ans, contre 2 % chez un sujet sain. L'atrophie corticale s'accompagne d'une dilatation des ventricules cérébraux et des sillons corticaux ainsi que d'une perte neuronale affectant particulièrement le système cholinergique (noyau basal de Meynert, septum, cortex entorhinal, amygdale et hippocampe).