Olestra - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
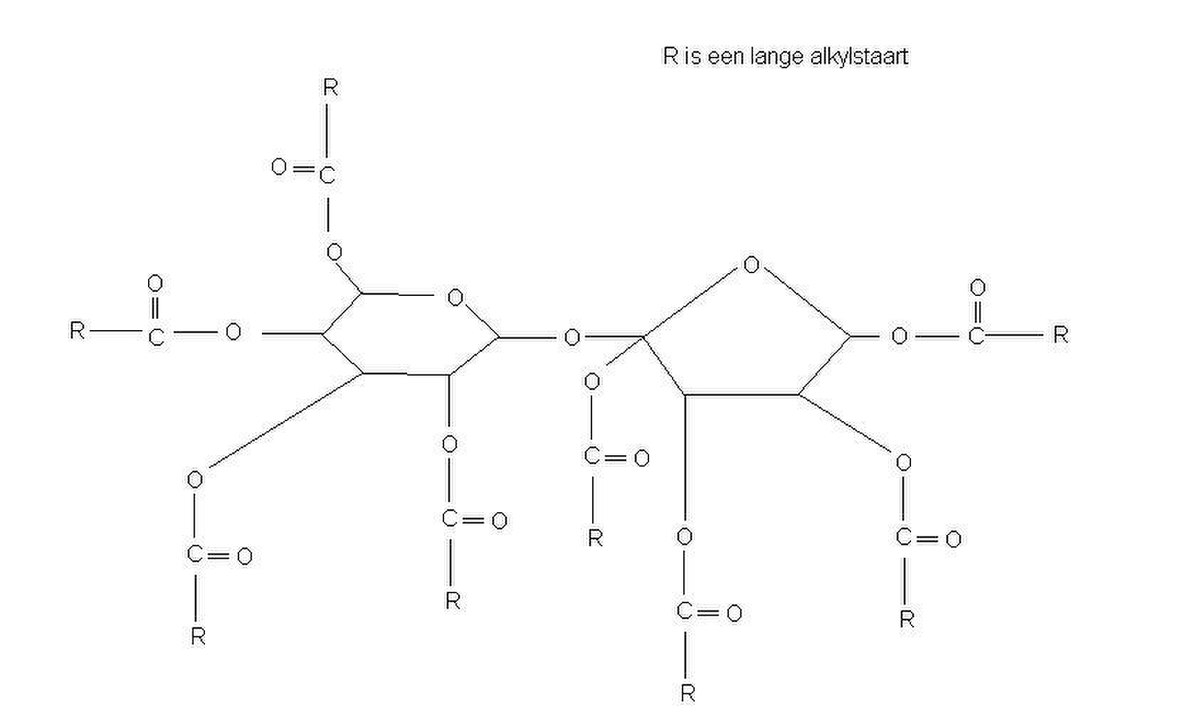
| Polyester de saccharose | |
|---|---|
| |
| Général | |
| No CAS | |
| | |
Olestra (aussi connu sous la marque Olean) est un substitut des graisses qui n'ajoute pas de matières grasses, de calories ou de cholestérol aux produits. Il a été utilisé dans la préparation d'aliments contenant traditionnellement beaucoup de graisses comme les chips, diminuant ou supprimant leur contenu en matières grasses.
Commercialisation
Olestra a été accidentellement découvert par les chercheurs de Procter & Gamble (P&G) F. Mattson et R. Volpenhein en 1968 pendant qu'ils recherchaient des gras qui pourraient être plus facilement digérés par les nouveau-nés prématurés. P&G rencontra la Food and Drug Administration (FDA) en 1971 pour examiner quels test pourraient être requis pour introduire Olestra comme additif alimentaire.
Pendant les tests suivants, P&G remarqua une baisse du taux de cholestérol dans le sang comme effet secondaire du remplacement des graisses naturelles par Olestra. Suivant cette possibilité potentiellement lucrative, P&G fit une nouvelle requête auprès de la FDA pour utiliser Olestra comme médicament, particulièrement pour diminuer les taux de cholestérol. Cependant les longues séries d'études qui suivirent ne réussirent pas à démontrer une baisse des 15% de cholestérol requis par la FDA pour être approuvé en tant que traitement. Les études qui suivirent n'aboutirent pas.
En 1984 la FDA autorisa Kellogg's à faire de la publicité pour leurs céréales à haute teneur en fibres qui réduisaient les risques de cancer. P&G redémarra immédiatement une autre série de tests qui durèrent trois ans. À la fin de ces études P&G refit une requête d'approbation comme additif alimentaire demandant à pouvoir utiliser Olestra pour le remplacement des graisses de cuisson à des teneurs supérieures à 35%, et pour un usage commercial à 75%.
Une des principales préoccupations de la FDA à propos d'Olestra était l'ironie qu'elle encouragerait les consommateurs à manger plus d'aliments situés au sommet de la pyramide alimentaire ayant l'impression qu'ils seraient plus sains, un paradoxe menant à une surconsommation pensant qu'Olestra le permettrait sans conséquences. Dans la lumière de ces faits, l'approbation d'Olestra comme additif alimentaire aurait signifié que les consommateurs consommeraient un aliment avec une part relativement élevée d'additif, sans que les effets à long terme sur la santé soient documentés. Ce fait rendit la FDA particulièrement hésitante à approuver le produit, en plus des autres effets secondaires comme la diarrhée et la perte des vitamines liposolubles. En août 1990, P&G firent le focus sur les amuse-gueule, chips, biscuits salés et autres aliments similaires.
À ce stade les brevets originaux approchaient de leur date d'expiration en 1995, alors P&G mit la pression pour obtenir une extension qu'il reçut en décembre 1993. Cette extension dura jusqu'au 25 janvier 1996. Comme le processus d'approbation continuait, P&G fut rejoint par d'autres compagnies qui accusèrent la FDA de traîner les pieds. Sous la pression, l'approbation vint enfin le 24 janvier, un jour avant la fin du brevet, reconduisant automatiquement celui-ci pour deux ans.
Olestra a été approuvé par la Food and Drug Administration en tant qu'additif alimentaire en 1996 et a été initialement utilisée dans des chips sous la marque WOW par Frito-Lay. En 1998, la première année où Olestra fut commercialisée à hauteur nationale, les ventes se chiffrèrent à 400 millions de dollars. Cependant en 2000 les ventes chutèrent à 200 millions de dollars.
Elle a en revanche été interdite au Canada.