Phénanthrène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Phénanthrène | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| No CAS | ||
| No EINECS | ||
| SMILES | ||
| InChI | ||
| Apparence | cristaux | |
| Propriétés chimiques | ||
| Formule brute | C14H10 | |
| Masse molaire | 178,2292 ± 0,0119 g·mol-1 178,23 g·mol-1 (de 178,22 à 178,24 selon les auteurs) | |
| Susceptibilité magnétique | χM 127,9×10-6 cm3·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 101 °C | |
| T° ébullition | 332 °C ébullition : 340 °C, Merck (1989), Prager (1995) | |
| Solubilité | Soluble dans les solvants organiques. Peu soluble dans l'eau : 1,2 mg·l-1 (à 25 °C) et 0,8 à 1,2 (à 25 °C) selon les auteurs Verschueren en 1996, Hansen en 1993 cités par l'INERIS. | |
| Masse volumique | 1,18 g·cm-3 (25 °C) ; Densité de vapeur, par rapport à l'air : 6,15 | |
| Pression de vapeur saturante | 12 mPa ou 0,091 Pa (20 °C) | |
| Point critique | 595,85 °C | |
| Thermochimie | ||
| Cp | ||
| Précautions | ||
| | ||
| ||
| Phrases R : 50/53, | ||
| Phrases S : 24/25, 61, | ||
| | ||
|
1 1 0 | ||
| | ||
| Produit non contrôlé | ||
| | ||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | ||
| | ||
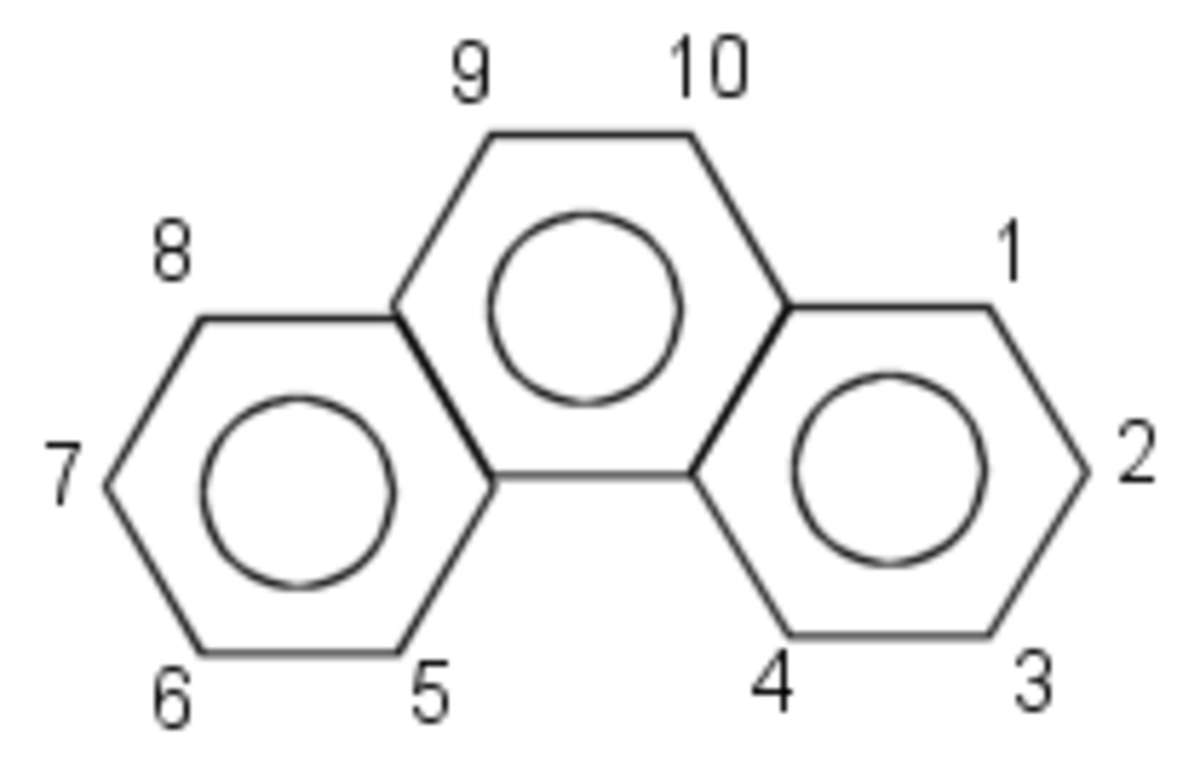
Le phénanthrène (provenant de phényl et anthracène) est un hydrocarbure aromatique polycyclique (HAP) composé de trois anneaux (noyaux ou cycles) de benzène (C'est un HAP dit tricyclique). Ces anneaux sont fusionnés et de formule C14 H10.
Il a cinq structures de résonance.
C'est un composé organique (toxique) qui fait partie des polluants organiques persistants (POPs). On le trouve dans l'environnement surtout dans les sols et les sédiments, et il est essentiellement produit avec les goudrons, par une mauvaise combustion des hydrocarbures ou du bois (inserts, foyers fermés faiblement alimentés en air). Il n'est pas considéré comme très toxique parmi les HAP, mais il a peu été étudié de ce point de vue. Son seuil olfactif est de 7×10-3 ppm
Très peu soluble dans l’eau et dans l'air (à température ambiante), il est peu mobile dans le sol où il s'adsorbe sur les particules grasses ou la matière organique (lipides notamment).
In vitro et chez le cobaye, il pénètre très bien la peau (chez l’animal la peau absorbe 80 % du phénanthrène qui y est appliqué).
Chimie
Les réactions typiques du phénanthrène concernent les positions 9 et 10 .
Sous sa forme solide, il se présente en cristaux incolores brillants monocliniques.
Densité de la vapeur (par rapport à l'air) : 6,15
Densité (solide) d204 = 1,179 à 25 °C
Log Kow 4,57 (4,28 à 4,63 selon les auteurs) Hansen et al. (1993)
Constante de Henry (Pa·m³·mol⁻¹)
- 2,90 Pa·m3·mol-1 à 20 °C
- 3,98 Pa·m3·mol-1 à 25 °C
- 0,61 Pa·m3·mol-1 - 4,56 Pa·m3·mol-1 de 20 à 25 °C selon les auteurs Maagd et al. (1998), Mackay et al. (1979)
Coefficient de diffusion dans l’air 5,4×10-2 cm2·s.
Coefficient de diffusion dans l’eau 5,7×101 cm2·s.
Coefficient de diffusion à travers le PEHD 2,0×10-7 m2·j
Perméabilité cutanée à une solution aqueuse : faute de valeur expérimentale disponible, l'INERIS a proposé de retenir la valeur de 0,23 cm·h-1, calculée à partir du Kow du phénanthrène par l'US EPA (1992).
Facteur de conversion (dans l'air à 20 °C):
- 1 ppm = 7,41 mg·m-3 et
- 1 mg·m-3 = 0,13 ppm



















































