Affinité électronique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L’affinité électronique, parfois notée AE, est la quantité d’énergie dégagée suite à la capture d’un électron par un atome en phase gazeuse. Plus l'affinité électronique est grande plus la capture d'un électron par l'atome dégage de l'énergie et plus cette capture est stable. Une affinité électronique négative signifie au contraire qu'il faut fournir de l'énergie à l'atome pour lui attacher un électron.
Cette énergie est souvent rapportée en kJ/mol dans les ouvrages de références. D'un point de vue thermodynamique, l’affinité électronique est la variation d’enthalpie, ΔH, de la réaction de capture d’un électron. Si l’élément capte l’électron et produit un dégagement d’énergie, la réaction est exothermique et ΔH est affecté d’un signe négatif. Toutefois, il existe une convention selon laquelle, les valeurs d’affinité électroniques sont données en valeurs absolues (comme dans le tableau plus bas). Selon cette convention, plus la valeur d’affinité électronique est grande, plus l’élément est un bon capteur d’électrons.
Le processus selon lequel le premier électron capté par l’élément est nommé première affinité électronique. Le processus selon lequel le deuxième électron est capté par l’élément est nommé deuxième affinité électronique et ainsi de suite.
De façon générale pour un élément X la réaction associée à l'affinité électronique est :
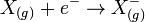
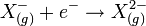
Exemple de l'Oxygène
Espèce neutre :
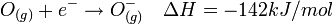
La valeur de ΔH est négative et la réaction est exothermique. Il est donc favorable pour l’oxygène de capter un électron.
Anion :

La valeur de ΔH est positive et la réaction est endothermique. L’ajout d’un 2e électron n’est pas favorable. La charge négative de l’anion O- crée une répulsion importante rendant difficile la capture du deuxième.
Discussion pour quelques familles chimiques
Les halogènes (Fluor F, Chlore Cl, Brome Br, Iode I - le groupe 7A), auxquels il ne manque qu'un électron pour adopter la structure électronique du gaz rare le plus proche, ont une grande tendance à capter un électron et former l'anion correspondant (F-, Cl-, Br-, I- etc). Dans cette famille, les éléments ont une grande affinité électronique car une de leurs orbitales p n’est pas entièrement remplie et peut recevoir un électron. Ce processus est favorisé énergétiquement (exothermique). Ceci n’est pas le cas dans l’éventualité d’un ajout d’un électron additionnel. Une telle réaction serait très endothermique car l’électron devrait être ajouté sur la couche électronique suivante de plus haute énergie. De ce fait, l’électron est très peu attiré par le noyau.
Leur structure ionique est donc très stable car leur affinité électronique est importante. Par exemple, un atome de chlore captant un électron forme l'anion chlorure et fournit 349 kJ/mol à l'environnement à l'issue de cette réaction.
Par contre, dans le cas du fluor, la première affinité électronique est inférieure à la valeur prévue. Ceci s’explique par la petite taille des orbitales 2p de cet élément qui font en sorte que les électrons, très rapprochés les uns des autres, subissent d’importantes forces de répulsion entre eux. « Dans les autres halogènes, les orbitales sont plus grandes et par conséquent, les répulsions sont moins fortes».
Les métaux alcalins (Lithium Li, Sodium Na, Potassium K, Rubidium Rb) doivent perdre un électron pour adopter la structure électronique du gaz rare le plus proche. Ils possèdent donc un potentiel d'ionisation très faible. Les affinités électroniques, sont elles aussi sont très faibles, il n'y a qu'un faible gain énergétique à former des anions de ces éléments.
Les gaz rares ont une affinité électronique presque nulle, car leurs orbitales respectives sont entièrement remplies, leur conférant une stabilité inégalée.

















































