Chlorure d'hydrogène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure d'hydrogène | |||||
|---|---|---|---|---|---|
| |||||
| Général | |||||
| Nom IUPAC | |||||
| No CAS | |||||
| No EINECS | |||||
| Apparence | gaz comprime liquéfié, incolore, d'odeur acre. | ||||
| Propriétés chimiques | |||||
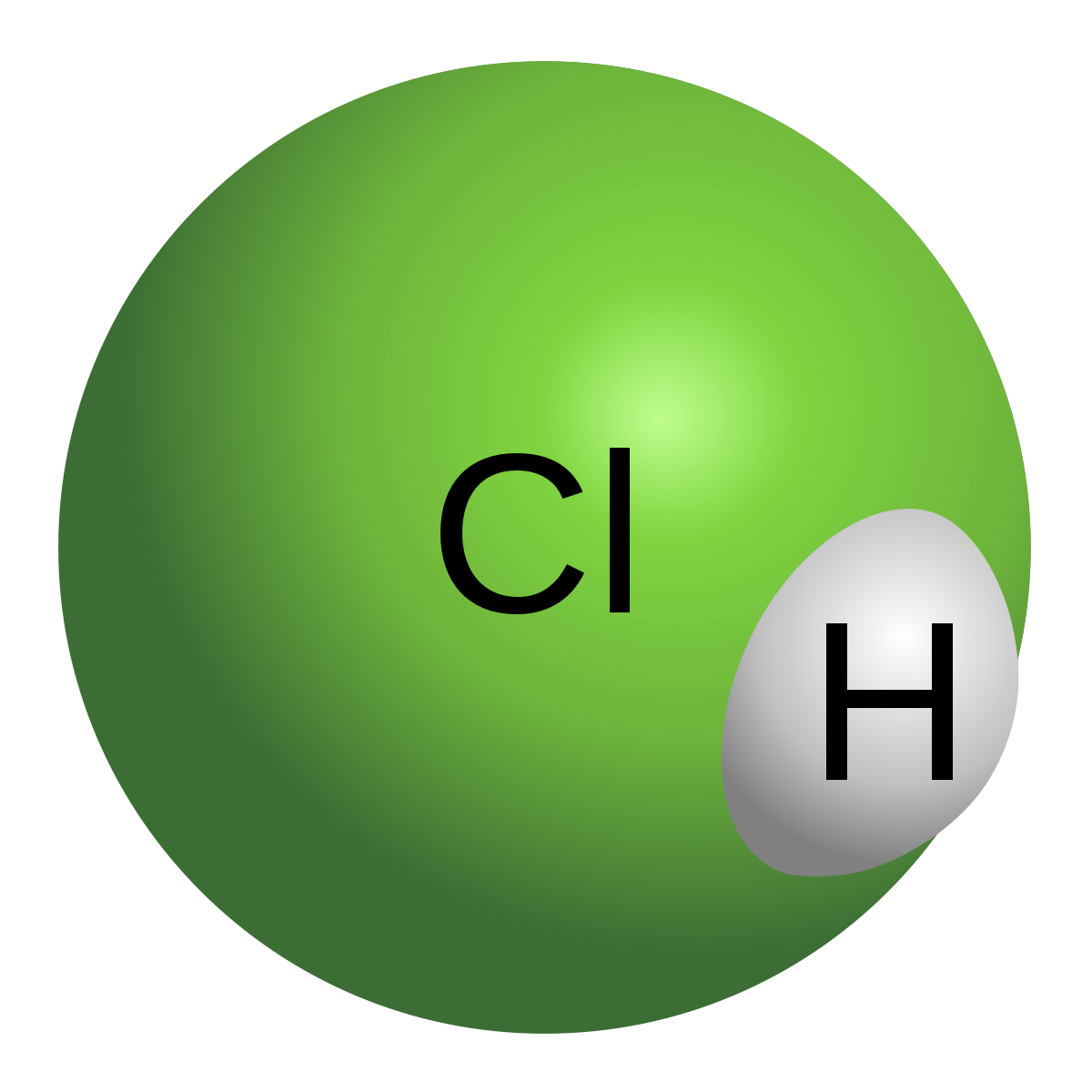
| Formule brute | HCl | ||||
| Masse molaire | 36,461 ± 0,002 g·mol-1 | ||||
| pKa | -4 | ||||
| Moment dipolaire | 1,1086 ± 0,0003 D | ||||
| Propriétés physiques | |||||
| T° fusion | -114 °C | ||||
| T° ébullition | à 101,3 kPa : -85 °C | ||||
| Solubilité | dans l'eau à 20 °C : 720 g·l-1 | ||||
| Masse volumique | 1,00045 g·l-1 (gaz) | ||||
| Pression de vapeur saturante | |||||
| Point critique | 51,35 °C, 8,26 MPa | ||||
| Point triple | 160 K (-114 °C), 13,8 kPa | ||||
| Thermochimie | |||||
| S0 | 186,90 J/mol·K | ||||
| ΔH0 | -92,31 kJ/mol | ||||
| ΔH° | 16,15 kJ·mol-1 (1 atm, -85 °C); 9,08 kJ·mol-1 (1 atm, 25 °C) | ||||
| Cp | 29,14 J/mol·K (25 °C) | ||||
| Précautions | |||||
| | |||||
| |||||
| Phrases R : 23, 35, | |||||
| Phrases S : 1/2, 9, 26, 36/37/39, 45, | |||||
| | |||||
| |||||
| | |||||
|
2 3 1 | |||||
| | |||||


| |||||
| | |||||



Danger | |||||
| Inhalation | amener à l'air frais, éventuellement réanimation cardiopulmonaire | ||||
| Peau | enlever les vêtements souillés, laver à grande eau, montrer à un médecin | ||||
| Yeux | laver à grande eau en maintenant les paupières ouvertes, montrer à un ophtalmologiste | ||||
| Ingestion | ne pas faire boire, ne pas faire vomir, contacter un médecin. | ||||
| Écotoxicologie | |||||
| Seuil de l’odorat | bas : 0,25 ppm haut : 10,06 ppm | ||||
| | |||||
Le chlorure d’hydrogène, de symbole chimique HCl, est un gaz incolore toxique et hautement corrosif, qui forme des fumées blanches au contact de l’humidité. Ces fumées sont constituées d’acide chlorhydrique, qui se forme lorsque le chlorure d’hydrogène se dissout dans l’eau. Le chlorure d’hydrogène, à l’instar de l'acide chlorhydrique, est un produit chimique important en chimie, dans l’industrie ou dans la science. Le nom HCl se réfère parfois de manière impropre à l’acide chlorhydrique au lieu du chlorure d’hydrogène gazeux. Les chimistes parlent également d'acide chlorhydrique gazeux ou anhydre pour se référer au chlorure d'hydrogène.
Histoire
Le chlorure d’hydrogène est connu depuis le Moyen Âge, où les alchimistes savaient que l’acide chlorhydrique (connu alors sous le nom d’esprit de sel ou acidum salis) était dans certaines circonstances lié à des vapeurs appelées gaz acide marin.
Au XVIIe siècle, Johann Rudolf Glauber utilisa du sel (chlorure de sodium) et de l’acide sulfurique pour fabriquer du sulfate de sodium, avec pour produit secondaire de réaction du chlorure d’hydrogène :
2 NaCl + H2SO4 → 2 HCl + Na2SO4
Cette découverte est parfois attribuée à Carl Wilhelm Scheele, qui mit également en œuvre cette réaction en 1772. Joseph Priestley obtint du chlorure d’hydrogène pur en 1772, et en 1818, Humphry Davy démontra que ce gaz est composé d’hydrogène et de chlore.
Au cours de la révolution industrielle, la demande pour des substances alcalines, et notamment de carbonate de sodium devint de plus en plus importante. Nicolas Leblanc développa un nouveau procédé industriel de production de carbonate de sodium. Dans le procédé Leblanc, du sel (chlorure de sodium) est converti en carbonate de sodium en utilisant de l’acide sulfurique, de la craie et du charbon, avec une production secondaire de chlorure d’hydrogène. Jusqu’à la promulgation au Royaume-Uni de l’Alkali Act en 1863, ce dernier était libéré dans l'air. Les producteurs de carbonate de sodium durent alors le dissoudre dans l’eau, ce qui permit de produire de l’acide chlorhydrique à l’échelle industrielle. Plus tard, le procédé Hargreaves fut développé, similaire au procédé Leblanc à ceci près que l’acide sulfurique est remplacé par du dioxyde de soufre, de l’eau et l’air. Au début du XXe siècle, le procédé Leblanc fut remplacé par le procédé Solvay qui ne produit pas de chlorure d’hydrogène. Cependant, le chlorure d’hydrogène constitue toujours une étape dans la production de l’acide chlorhydrique.




















































