Chlorure d'hydrogène - Définition
La liste des auteurs de cet article est disponible ici.
Production
La majeure partie du chlorure d’hydrogène produit dans l’industrie est utilisée pour la production d’acide chlorhydrique.
Une méthode courante de production de chlorure d’hydrogène dans l’industrie est le « four HCl », dans lequel du dihydrogène et du dichlore gazeux réagissent au cours d'une réaction exothermique pour former du chlorure d’hydrogène :
Cette réaction est utilisée pour fabriquer un produit très pur, destiné notamment à l’industrie alimentaire.
Le chlorure d’hydrogène peut également être produit à partir du dichlore et de composés contenant de l’hydrogène comme par exemple les hydrocarbures. La chloration des composés organiques peut donner lieu à la production de chlorure d’hydrogène :
La réaction de produits chlorés avec du fluorure d’hydrogène pour former des composés fluorés permet également de produire du chlorure d’hydrogène :
Lorsque ces réactions ont lieu en milieu anhydre (absence d’eau), il se forme du HCl gazeux.
Le chlorure d’hydrogène peut également être produit à l’échelle industrielle à partir de chlorure de sodium (NaCl) et d’acide sulfurique.
Synthèse du chlorure d'hydrogène
Le chlorure d’hydrogène peut être synthétisé en ajoutant lentement de l’eau (ou un acide) à certains réactifs chlorés en excès, tels que des chlorures de phosphore, le chlorure de thionyle (SOCl2) ou des chlorures d’acyle. Un ajout trop important d’eau peut conduire à la dissolution du chlorure d’hydrogène formé et à la formation d’acide chlorhydrique. Par exemple, l’ajout lent d’eau froide au pentachlorure de phosphore conduit à la formation d’HCl suivant :
Un ajout d’eau chaude permet d’obtenir plus de HCl en hydrolysant PCl5 en acide phosphorique. La réaction chimique entre l’eau et le trichlorure de phosphore PCl3 produit également du HCl.
La réaction du chlorure de thionyle avec l’eau produit du HCl ainsi que du dioxyde de soufre SO2. Pour les réactions du chlorure de thionyle ou des chlorure d’acyle avec l’eau, voir chlorure de thionyle et chlorure d'acyle.
Générateur d’HCl
Il est possible de préparer de petites quantités d’HCl pour une utilisation en laboratoire en utilisant un générateur d’HCl suivant différentes méthodes :
- libération à partir d’acide chlorhydrique concentré en utilisant de l’acide sulfurique concentré.
- libération à partir d’acide chlorhydrique concentré en utilisant du chlorure de calcium anhydre.
- en faisant réagir de l’acide sulfurique et du chlorure de sodium suivant : NaCl + H2SO4 → NaHSO4 + HCl↑
Généralement, l’acide chlorhydrique ou l’acide sulfurique est ajouté goutte à goutte au réactif dans un ballon. L’HCl peut être séché en le faisant buller au travers d’acide sulfurique concentré.
Chimie
La molécule de chlorure d’hydrogène HCl est une molécule diatomique constituée d’un atome d’hydrogène H et d'un atome de chlore Cl, liés par une liaison simple. Le chlore étant nettement plus électronégatif que l’hydrogène, la liaison est polarisée. En conséquence, la molécule porte un moment dipolaire important, avec une charge partielle négative δ- portée par l’atome de chlore et une charge partielle positive δ+ portée par l’atome d’hydrogène. Le chlorure d’hydrogène est donc une molécule polaire. Elle est très soluble dans l’eau et dans les solvants polaires.
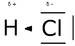
Au contact de l’eau, le chlorure d’hydrogène s’ionise pour former des anions chlorures Cl- et des cations hydronium H3O+ (H+ solvaté :
- HCl + H2O → H3O+ + Cl-
La solution résultant de la réaction est appelée acide chlorhydrique. C’est un acide fort ce qui signifie que la constante d’acidité Ka (qui est liée au taux de dissociation de la molécule d’HCl) est très élevée : le chlorure d’hydrogène se dissocie presque totalement dans l’eau.
Même en l’absence d’eau, le chlorure d’hydrogène agit tout de même comme un acide. Par exemple, HCl peut se dissoudre dans d’autres solvants comme le méthanol et protoner des ions ou des molécules, agissant comme acide catalyseur pour certaines réactions chimiques pour lesquelles des conditions anhydres (absence totale d'eau) sont nécessaires.
- HCl + CH3OH → CH3O+H2 + Cl-
Du fait de sa nature acide, le chlorure d'hydrogène est un gaz corrosif, tout particulièrement en présence d’humidité (2–5 ppm d'eau suffisent).


















































